Step 1 of 4
Altérations de la cinétique segmentaire
Anatomie coronarienne
Dans une position intermédiaire entre la vue court-axe de la valve aortique (40°) et la vue court-axe de l’aorte ascendante (0°), on aperçoit clairement l’origine du tronc commun (TC) au milieu du sinus de Valsalva gauche (à 2 heures). Le départ de la coronaire droite (CD), au milieu du sinus de Valsalva droit, est situé à 6-7 heures. Comme le trajet des deux vaisseaux n’est pas dans le même plan, il est rare de les voir dans la même vue. La dimension des ostia coronariens est de 4-8 mm. Le TC se divise en artère interventriculaire antérieure (IVA), qui se dirige verticalement vers le bas de l’écran (flux parallèle à l’axe Doppler), et en artère circonflexe (CX), qui se dirige vers le sillon auriculo-ventriculaire gauche et passe sous l’appendice auriculaire gauche (à droite de l’écran); on la retrouve en court-axe en vue 2-cavités à 90°. La CD se coude peu après son départ pour s’orienter vers la gauche de l’écran. La CD est également visible en long axe de la valve aortique (120°), où elle se détache du sinus de Valsalva droit et se dirige vers le bas de l’écran (Figure 27.18). Selon l'orientation de l'aorte, notamment dans les bicuspidies, il arrive que l'autre sinus de Valsalva en long-axe ne soit pas le non-coronarien mais le coronarien gauche; on y voit alors le départ du TC. Il existe une multitude de variations anatomiques de l’arbre coronarien (voir Figure 27.197).
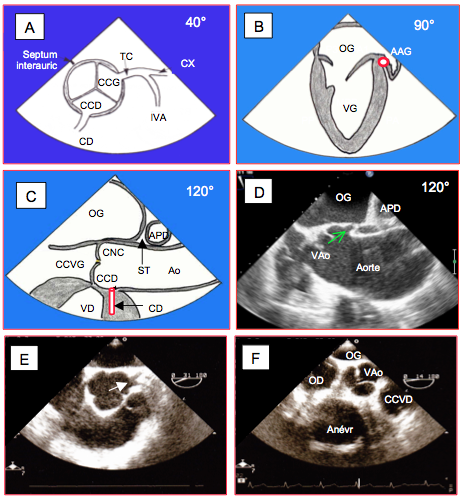
Figure 27.18 : Schéma anatomique et exemples d'anomalies coronariennes. A : Vue court-axe de l’aorte ascendante et de la valve aortique 0° - 40°, avec le tronc commun jusqu’à sa bifurcation (à 2 heures) et la coronaire droite (à 6 heures). B : Passage de l'artère circonflexe sous l'appendice auriculaire gauche (AAG) en vue 2-cavités 90°. C: Vue long-axe 120° de la valve aortique et de l’aorte ascendante avec le départ de la CD. D : vue identique dans un cas de bicuspidie avec présence du tronc commun là où se trouve normalement la cuspide non-coronaire. E : Tronc commun (TC) court. Un TC court ou une origine séparée de l’IVA et de la CX sont deux malformations précieuses à connaître avant d’administrer la cardioplégie par canulation directe des coronaires. F: anévrysme de la coronaire droite. TC : tronc commun. CX : artère circonflexe. IVA : artère interventriculaire antérieure. CD : artère coronaire droite. CCD : cuspide coronarienne droite de la valve aortique. CCG : cuspide coronarienne gauche. CNC : cuspide non-coronaire. APD : artère pulmonaire droite. ST : sinus transverse.
Les anomalies coronariennes se répartissent essentiellement en trois groupes.
Dans une position intermédiaire entre la vue court-axe de la valve aortique (40°) et la vue court-axe de l’aorte ascendante (0°), on aperçoit clairement l’origine du tronc commun (TC) au milieu du sinus de Valsalva gauche (à 2 heures). Le départ de la coronaire droite (CD), au milieu du sinus de Valsalva droit, est situé à 6-7 heures. Comme le trajet des deux vaisseaux n’est pas dans le même plan, il est rare de les voir dans la même vue. La dimension des ostia coronariens est de 4-8 mm. Le TC se divise en artère interventriculaire antérieure (IVA), qui se dirige verticalement vers le bas de l’écran (flux parallèle à l’axe Doppler), et en artère circonflexe (CX), qui se dirige vers le sillon auriculo-ventriculaire gauche et passe sous l’appendice auriculaire gauche (à droite de l’écran); on la retrouve en court-axe en vue 2-cavités à 90°. La CD se coude peu après son départ pour s’orienter vers la gauche de l’écran. La CD est également visible en long axe de la valve aortique (120°), où elle se détache du sinus de Valsalva droit et se dirige vers le bas de l’écran (Figure 27.18). Selon l'orientation de l'aorte, notamment dans les bicuspidies, il arrive que l'autre sinus de Valsalva en long-axe ne soit pas le non-coronarien mais le coronarien gauche; on y voit alors le départ du TC. Il existe une multitude de variations anatomiques de l’arbre coronarien (voir Figure 27.197).
Figure 27.18 : Schéma anatomique et exemples d'anomalies coronariennes. A : Vue court-axe de l’aorte ascendante et de la valve aortique 0° - 40°, avec le tronc commun jusqu’à sa bifurcation (à 2 heures) et la coronaire droite (à 6 heures). B : Passage de l'artère circonflexe sous l'appendice auriculaire gauche (AAG) en vue 2-cavités 90°. C: Vue long-axe 120° de la valve aortique et de l’aorte ascendante avec le départ de la CD. D : vue identique dans un cas de bicuspidie avec présence du tronc commun là où se trouve normalement la cuspide non-coronaire. E : Tronc commun (TC) court. Un TC court ou une origine séparée de l’IVA et de la CX sont deux malformations précieuses à connaître avant d’administrer la cardioplégie par canulation directe des coronaires. F: anévrysme de la coronaire droite. TC : tronc commun. CX : artère circonflexe. IVA : artère interventriculaire antérieure. CD : artère coronaire droite. CCD : cuspide coronarienne droite de la valve aortique. CCG : cuspide coronarienne gauche. CNC : cuspide non-coronaire. APD : artère pulmonaire droite. ST : sinus transverse.
Les anomalies coronariennes se répartissent essentiellement en trois groupes.
- Origine anormale; outre les variantes anatomiques du tronc commun comme l'insertion séparée de l'IVA et de la CX, l'origine des coronaires connaît des malformations congénitales importantes mais rares: coronaire gauche issue de l'artère pulmonaire (syndrome ALCAPA), ostium coronarien situé dans le mauvais sinus, trajet coronarien entre l'aorte et l'artère pulmonaire (voir Chapitre 14 Anomalies artérielles).
- Anévrysme; dilatation de > 1.5 fois du diamètre du tronc coronarien, apparaissant à l'écho comme une cavité supplémentaire au niveau d'un sillon auriculo-ventriculaire et présentant un flux au Doppler couleur (voir Figure 27.18F).
- Fistule; la communication entre un tronc coronarien et une chambre cardiaque, l'artère pulmonaire ou le sinus coronaire crée un shunt G – D qui peut entrainer une surcharge de volume pour le VG ou une ischémie distale par "vol" coronarien. A l'écho, la fistule se présente comme une dilatation du tronc coronaire concerné, avec un flux systolo-diastolique continu de haute vélocité.
Au moyen du Doppler couleur, il est possible de visualiser le flux dans les 2-3 premiers centimètres des troncs coronariens ; la limite de Nyquist est fixée à 0.5 m/s. Le flux est essentiellement diastolique dans le TC, mais systolo-diastolique dans la CD. Le Doppler pulsé peut être correctement aligné avec le flux dans l’IVA et dans la CD, ce qui en permet l’affichage spectral (Figure 27.19). Toutefois, cet examen est peu précis parce que les vaisseaux suivent le mouvement translationnel et rotationnel du cœur en systole ; ils se déplacent de haut en bas, ce qui modifie la Vmax enregistrée, et sortent souvent de la fenêtre d’échantillonnage au cours du cycle cardiaque.
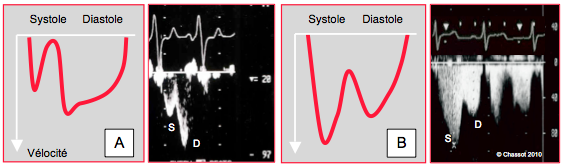
Figure 27.19 : Flux coronaire. A : flux dans l’artère interventriculaire antérieure (IVA) en vue basale court axe de la valve aortique à 40° ; la composante systolique S est de faible vélocité. B : flux dans la coronaire droite en vue long axe de la valve aortique à 120° ; le flux systolique S est plus important que le flux diastolique D.
Contraction segmentaire
La cinétique de chaque segment du ventricule gauche est une visualisation en temps réel de la performance systolique des trois territoires coronariens, donc un reflet de l'adéquation de leur perfusion. La contraction normale est définie par un épaississement et un raccourcissement de paroi. La perfusion myocardique est répartie en 3 territoires correspondant aux 3 troncs coronariens : artères coronaire droite (CD), interventriculaire antérieure (IVA) et circonflexe (CX). La paroi du VG est divisée en quatre régions, ou portions de cercle en court-axe: antérieure, latérale, inférieure et septale. En longueur, le ventricule est divisé en trois niveaux de long-axe: basal, médio-ventriculaire et apical.
Figure 27.19 : Flux coronaire. A : flux dans l’artère interventriculaire antérieure (IVA) en vue basale court axe de la valve aortique à 40° ; la composante systolique S est de faible vélocité. B : flux dans la coronaire droite en vue long axe de la valve aortique à 120° ; le flux systolique S est plus important que le flux diastolique D.
Contraction segmentaire
La cinétique de chaque segment du ventricule gauche est une visualisation en temps réel de la performance systolique des trois territoires coronariens, donc un reflet de l'adéquation de leur perfusion. La contraction normale est définie par un épaississement et un raccourcissement de paroi. La perfusion myocardique est répartie en 3 territoires correspondant aux 3 troncs coronariens : artères coronaire droite (CD), interventriculaire antérieure (IVA) et circonflexe (CX). La paroi du VG est divisée en quatre régions, ou portions de cercle en court-axe: antérieure, latérale, inférieure et septale. En longueur, le ventricule est divisé en trois niveaux de long-axe: basal, médio-ventriculaire et apical.
- En vue 4-cavités rétrocardiaque à 0°, parois septale et latérale.
- En vue 2-cavités rétrocardiaque à 90°, parois antérieure et inférieure.
- En vue long-axe rétrocardiaque à 120°, paroi postérieure et antéro-septale.
- En vue transgastrique court-axe à 0°, parois septale, inférieure, postérieure, latérale et antérieure du VG (en tournant dans le sens horaire). Cette incidence visualise simultanément les trois territoires coronariens dans leurs segments médio-ventriculaires, mais les deux tiers du VG échappent à cette vue, qui ne met en évidence que 17% des altérations de la cinétique segmentaire [12].
- L'apex anatomique est visible en 2 cavités à 90° et en long-axe à 120° ; c’est la région la plus difficile à visualiser correctement en ETO car elle est régulièrement amputée dans les vues standard. Elle présente un degré d’épaississement supérieur au reste du VG.
Pour affiner cette répartition et correspondre à la vascularisation coronarienne, le VG est divisé en 17 segments: six au niveau basal, six au niveau mi-ventriculaire, quatre au niveau apical et un formant la coiffe apicale [2]. Au niveau basal (segments 1 à 6) et mi-ventriculaire (segments 7 à 12), le pourtour ventriculaire est découpé de la manière suivante.
- 1 et 7: région antérieure;
- 2 et 8: région antéro-septale;
- 3 et 9: région inféro-septale,
- 4 et 10: région inférieure;
- 5 et 11: région inféro-latérale;
- 6 et 12: région antéro-latérale.
Au niveau apical, la paroi n'est divisée qu'en 4 segments parce que le diamètre devient plus étroit.
- 13: région antérieure;
- 14: région septale;
- 15: région inférieure;
- 16: région latérale;
- 17: coiffe apicale (au-delà de la cavité du VG).
La numérotation la plus courante est celle de l'American Heart Association illustrée dans la Figure 27.20 [2,5]. Mais il en existe des variantes à 16 ou 18 segments. D'autre part, certaines publications utilisent une numérotation un peu différente (American Society of Echocardiography) reproduite dans la Figure 25.118 [6].

Figure 27.20 : Représentation schématique des différents territoires coronariens vascularisés par chaque tronc artériel dans les coupes échocardiographiques transoesophagiennes habituelles du ventricule gauche (court-axe transgastrique médioventriculaire 0°, 2-cavités 90° et 4-cavités 0°). La numérotation commence à la base. Le VG est divisé en trois parties (basale, moyenne, distale) ; la partie apicale est le 17ème segment. Le vue schématique est la représentation en "œil-de-poisson" centrée sur l'apex avec affichage des 17 segments et des 3 territoires coronariens: coronaire droite (CD) en jaune, circonflexe (CX) en rouge, et interventriculaire antérieure (IVA) en vert [2,5].
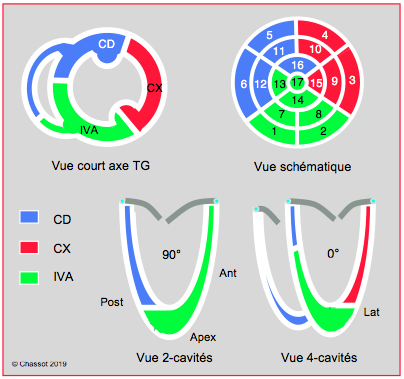
Figure 25.118 : Territoires coronariens en vue court axe transgastrique (TG), en vues 2 cavités et 4 cavités rétrocardiaques, et en vue schématique. Cette dernière montre la vascularisation des différents segments. CD : artère coronaire droite. CX : artère circonflexe. IVA : artère interventriculaire antérieure. Les segments 13, 15 et 17 peuvent être vascularisés par la CD (interventriculaire postérieure) ou l’IVA (interventriculaire antérieure). Le segment 14 peut être vascularisé par l’IVA ou la CX, et le segment 16 par la CX ou la CD.
La contraction segmentaire est caractérisée par deux mouvements : un épaississement et un raccourcissement. Les deux éléments doivent être présents pour que la contraction puisse être qualifiée de normale. En systole, le myocarde s'épaissit de 30 à 40% ; le raccourcissement radiaire est de 20-45% et le raccourcissement longitudinal de 15-20%; la torsion systolique du VG est de 15-20°. La grande fourchette de ces valeurs vient du fait que la course radiaire de chacune des 4 parois du VG n’est pas la même (Vidéo et Figure 27.21) [7,8].
Vidéo: vue court-axe transgastrique d'un ventricule gauche normal; les parois antérieure (en bas à l'écran) et latérale (à droite) ont une course radiaire plus grande que la paroi postéro-inférieure (en-haut) et que le septum (à gauche).
Figure 27.20 : Représentation schématique des différents territoires coronariens vascularisés par chaque tronc artériel dans les coupes échocardiographiques transoesophagiennes habituelles du ventricule gauche (court-axe transgastrique médioventriculaire 0°, 2-cavités 90° et 4-cavités 0°). La numérotation commence à la base. Le VG est divisé en trois parties (basale, moyenne, distale) ; la partie apicale est le 17ème segment. Le vue schématique est la représentation en "œil-de-poisson" centrée sur l'apex avec affichage des 17 segments et des 3 territoires coronariens: coronaire droite (CD) en jaune, circonflexe (CX) en rouge, et interventriculaire antérieure (IVA) en vert [2,5].
Figure 25.118 : Territoires coronariens en vue court axe transgastrique (TG), en vues 2 cavités et 4 cavités rétrocardiaques, et en vue schématique. Cette dernière montre la vascularisation des différents segments. CD : artère coronaire droite. CX : artère circonflexe. IVA : artère interventriculaire antérieure. Les segments 13, 15 et 17 peuvent être vascularisés par la CD (interventriculaire postérieure) ou l’IVA (interventriculaire antérieure). Le segment 14 peut être vascularisé par l’IVA ou la CX, et le segment 16 par la CX ou la CD.
La contraction segmentaire est caractérisée par deux mouvements : un épaississement et un raccourcissement. Les deux éléments doivent être présents pour que la contraction puisse être qualifiée de normale. En systole, le myocarde s'épaissit de 30 à 40% ; le raccourcissement radiaire est de 20-45% et le raccourcissement longitudinal de 15-20%; la torsion systolique du VG est de 15-20°. La grande fourchette de ces valeurs vient du fait que la course radiaire de chacune des 4 parois du VG n’est pas la même (Vidéo et Figure 27.21) [7,8].
Vidéo: vue court-axe transgastrique d'un ventricule gauche normal; les parois antérieure (en bas à l'écran) et latérale (à droite) ont une course radiaire plus grande que la paroi postéro-inférieure (en-haut) et que le septum (à gauche).
- Paroi latérale : 45% ;
- Paroi antérieure : 38% ;
- Paroi postérieure : 30% ;
- Paroi septale : 20%.
Figure 27.21 : Les quatre quadrants du VG n’ont pas le même raccourcissement radiaire. Ce dernier est plus important dans les parois latérale et antérieure, et plus faible dans les parois postérieure et septale. Il est plus marqué à la base qu’à l’apex dans les parois antérieure et latérale, mais plus faible à la base dans la paroi postérieure ; de ce fait, la partie postéro-basale semble souvent hypokinétique par rapport au reste du VG. Le septum a la course radiaire la plus faible [8].
La partie sous-endocardique a un déplacement radiaire qui est le double de celui de la partie sous-épicardique. L’épaississement et le mouvement de torsion systolique sont plus importants à l’apex qu’à la base. La contraction commence à l’apex et se termine dans la chambre de chasse. Cette hétérogénéité de la contraction ventriculaire gauche a des conséquences sur l’examen échocardiographique.
- Le grand déplacement des parois latérale et antérieure en fait les régions les plus importantes pour la performance ventriculaire.
- Ayant une course radiaire de moindre amplitude, la paroi postéro-basale peut paraître hypokinétique à l’examen échocardiographique alors que sa contraction est physiologique.
- Le septum basal, partiellement fibreux, a peu d’épaississement.
- La contraction des segments basaux (grand diamètre) propulse davantage de volume que celle des segments apicaux (petit diamètre). Par contre, la fraction de raccourcissement de surface en court-axe est plus élevée à l'apex qu'à la base, parce qu'elle varie inversement avec la surface télédiastolique, qui est au dénominateur de la fraction.
- Il faut un minimum de deux quadrants fonctionnels pour assurer la survie du patient.
- Un infarctus a un retentissement hémodynamique différent selon sa localisation.
Ischémie myocardique
La recherche d’altérations de la cinétique segmentaire (ACS) commande obligatoirement de balayer la totalité des différents territoires coronariens et d’y observer le degré de raccourcissement radiaire et d’épaississement de paroi. Il se peut que certains segments aient un déplacement vers le centre dû à la contraction des zones adjacentes, d’où l’importance d’en observer simultanément le degré d’épaississement, et de visualiser chaque région dans plusieurs plans. Une altération locale de la cinétique segmentaire n'est réelle que si elle est observée dans plusieurs vues. Les mouvements de translation et de rotation du cœur gênent la lecture des déplacements segmentaires, mais non leur épaississement. Les vues tronquées ou tangentielles induisent en erreur ; il est de la plus haute importance de respecter strictement les plans de coupe standard. Les ACS sont classées en cinq catégories (Tableaux 27.3 et 27.4).
La recherche d’altérations de la cinétique segmentaire (ACS) commande obligatoirement de balayer la totalité des différents territoires coronariens et d’y observer le degré de raccourcissement radiaire et d’épaississement de paroi. Il se peut que certains segments aient un déplacement vers le centre dû à la contraction des zones adjacentes, d’où l’importance d’en observer simultanément le degré d’épaississement, et de visualiser chaque région dans plusieurs plans. Une altération locale de la cinétique segmentaire n'est réelle que si elle est observée dans plusieurs vues. Les mouvements de translation et de rotation du cœur gênent la lecture des déplacements segmentaires, mais non leur épaississement. Les vues tronquées ou tangentielles induisent en erreur ; il est de la plus haute importance de respecter strictement les plans de coupe standard. Les ACS sont classées en cinq catégories (Tableaux 27.3 et 27.4).
- 1 - Normokinésie ; la paroi du VG s’épaissit de 35-45% en systole, le raccourcissement radiaire est > 30%.
- 2 - Hypokinésie légère ; épaississement et raccourcissement radiaire de 10-30% ; correspond à une diminution de 50% du flux coronaire.
- 3 - Hypokinésie sévère ; épaississement et raccourcissement radiaire de ≤ 10% ; correspond à un infarcissement de 20% de l’épaisseur de paroi.
- 4 - Akinésie ; absence d’épaississement, paroi inerte ; diminution du flux coronaire à 5-10% de la norme, infarcissement de > 35% de l’épaisseur de paroi. La zone immobile peut apparaître plus importante que celle qui est réellement ischémiée à cause de la traction effectuée sur le voisinage par la région akinétique (tethering effect). Une akinésie de la région apicale se traduit typiquement par un apex dilaté et arrondi en vue 2-cavités et long-axe (Vidéos et Figure 27.22).
- 5 - Dyskinésie ; le segment s’expand en systole au lieu de se contracter (mouvement paradoxal) ; l’anévrysme en est un cas particulier.
Vidéo: vue transoesophagienne 4-cavités 0° d'une akinésie antéro-apicale étendue; la paroi latérale se contracte alors que la paroi antéro-apicale est arrondie et immobile.
Vidéo: vue 2-cavités 90° du même cas; la partie basale de la paroi antérieure se contracte alors que sa partie médio-apicale est akinétique. La partie postéro-apicale est dyskinétique.
Vidéo: vue long-axe 120° de la paroi antéro-septale et de l'apex, tous deux akinétiques; les zones hyperéchogènes sont cicatricielles.
Vidéo: vue 5-cavités 0° d'une akinésie étendue du VG; seule la partie latéro-basale est contractile. Le VG est dilaté, arrondi et défaillant. Cette situation demande la pose d'une assistance ventriculaire.
Vidéo: vue 2-cavités 90° d'une akinésie totale de la paroi antérieure (obstruction de l'IVA).
Vidéo: vue 4-cavités 0° d'une akinésie totale de la paroi latérale après pontage aorto-coronarien; le pontage sur la circonflexe est inopérant (obstruction de l'anastomose).
Figure 27.22 : Akinésie apicale. A et B: akinésie antéro-apicale (flèches rouges); cette zone n'a pas bougé entre la diastole (A) et la systole (B), bien que le diamètre septo-latéral (flèche verte) se soit rétrécit en systole (valve mitrale fermée) grâce au déplacement radiaire adéquat de la paroi latérale et modeste du septum. C: l'apex est dilaté et arrondi (flèches jaunes) en vue long-axe, alors que sa configuration anatomique normale est pointue.
L’addition des points (1 à 5) divisée par le nombre de segments observés permet de construire un score d’ischémie de 1.0 à 3.9, utile pour quantifier les ACS. Pour être significative, une nouvelle ACS doit représenter une aggravation de 2 échelons. Il faut une réduction du flux coronarien d’au moins 50% pour voir apparaître une ACS. Une hypokinésie correspond à un infarctus de 20% de l’épaisseur de paroi, et une akinésie à un infarctus de > 40%.
L'échocardiographie présente une haute sensibilité pour le diagnostic des ACS (93%), mais une faible spécificité pour leur origine ischémique (31%) [9]. Il peut être impossible de distinguer une ischémie aiguë d'un infarctus ancien, sauf si l'aspect fibreux hyperéchogène et l'amincissement de la paroi suggèrent la chronicité (Figure 27.23).
Figure 27.23 : Akinésie pariétale sur un infarctus. A: la paroi antérieure est mince et échogène, traduisant un processus fibreux cicatriciel irréversible. B: la paroi latérale est d'épaisseur normale mais moins échogène que le septum; bien qu'ischémiée et akinétique, elle peut récupérer une certaine contractilité par une revascularisation.
En cas d’akinésie, l’aspect structurel du myocarde a une valeur pronostique : s’il paraît normal, il se peut que le myocarde puisse récupérer après une revascularisation, car il s'agit le plus souvent d'une hibernation; au contraire, une zone très échogène et amincie (< 6 mm) est probablement infarcie et cicatricielle (Vidéos). Une reprise de la contraction sous perfusion de dobutamine (5-10 mcg/kg/min) est caractéristique d’une zone récupérable, donc justifiant un pontage aorto-coronarien, alors qu’une zone infarcie ne réagit pas. Ce phénomène a son importance en salle d’opération, car une revascularisation incomplète quadruple les risques de complications cardiaques. Toutefois, l'IRM est actuellement la meilleure technique pour juger la viabilité du myocarde. La maladie de Takotsubo, qui est une ballonisation apicale aiguë transitoire du VG, mime un infarctus mais ne montre aucune lésion coronarienne à l'angiographie et récupère dans les jours ou les semaines suivantes (Vidéos) (voir Figure 27.48). Les ACS peuvent également apparaître suite à des causes non-ischémiques.
Vidéo: vue 2-cavités montrant une akinésie antérieure aiguë pendant la confection du pontage aorto-coronarien sur l'IVA à coeur battant. La paroi antérieure est immobile mais elle est d'épaisseur et d'échogénicité normales.
Vidéo: vue long-axe d'une akinésie de la paroi antéro-septo-apicale; l'amincissement et l'hyperéchogénicité de la paroi laissent penser à une zone infarcie.
Vidéo: vue 4-cavités de la ballonisation apicale lors de maladie de Takotsubo.
Vidéo: vue long-axe de la ballonisation apicale lors de maladie de Takotsubo.
- Hétérogénéité accentuée de la contraction ventriculaire, hypokinésie relative normale de la paroi postéro-basale;
- Mouvements de translation et de rotation du coeur;
- Bloc de branche ou ou électro-entraînement par un pace-maker;
- Extrasystolie ventriculaire;
- Asynchronisme de contraction dû à une dilatation ventriculaire;
- Traction effectuée sur le voisinage par la région akinétique;
- Aplatissement du septum interventriculaire en cas de surcharge ventriculaire droite systolique (hypertension pulmonaire) ou diastolique (surcharge de volume) ; ce phénomène mime une hypokinésie septale (voir ci-dessous);
- Dyskinésie du septum interventriculaire (mouvement paradoxal) en cas de surcharge de pression droite due à la désynchronisation de la contraction systolique du VD et du VG;
- Dyskinésie septale lors de l’ouverture du péricarde (modification de l’interdépendance ventriculaire);
- Immobilisation basale par une prothèse mitrale;
- Augmentation brusque de postcharge ou baisse soudaine de précharge;
- Sensibilité abaissée lorsque la fonction ventriculaire est mauvaise;
- Artéfact: image court-axe oblique ou coupe tronquée de la paroi (le plus fréquent !).
Dans ces situations, l’observation du degré d’épaississement systolique de la paroi est un critère plus fiable que son déplacement. La présence d'ACS invalide le calcul de la fraction d'éjection (FE) au moyen d'approximations géométriques comme la formule de Teichholz; seule la mesure du volume réel en échocardiographie 3D, ou éventuellement la règle de Simpson sur deux plans orthogonaux, permet de formuler une FE cohérente.
Le septum interventriculaire peut présenter un mouvement paradoxal sous forme d’un basculement droite-gauche au cours de la systole. Plusieurs origines sont possibles.
Le septum interventriculaire peut présenter un mouvement paradoxal sous forme d’un basculement droite-gauche au cours de la systole. Plusieurs origines sont possibles.
- Bloc de branche : la désynchronisation fait que le septum ne se contracte pas simultanément avec le reste du ventricule ; il bascule entre la droite et la gauche en fonction de la pression intraventriculaire gauche et de sa propre contraction, qui est tardive.
- Pace-maker : la stimulation du septum est précoce, et sa relaxation a lieu avant la fin de la contraction du reste du VG.
- Péricardotomie : n’étant plus contenu par le péricarde, les ventricules peuvent se dilater ; le septum bascule dans le VD dont la pression baisse.
- Hypertension pulmonaire : comme le pic de pression du VD est plus retardé que normalement par rapport à celui du VG à cause de la postcharge élevée, le septum est d’abord repoussé vers la droite lorsque la pression intraventriculaire gauche est maximale, puis vers la gauche lorsque la pression intraventriculaire droite maximale droite est atteinte ; la haute pression droite en cas d’hypertension pulmonaire fait alors basculer le septum dans le VG en télésystole et protodiastole.
- Surcharge de volume : la dilatation diastolique du VD repousse le septum vers la gauche ; ce dernier reprend sa position en systole.
- Péricardite constrictive ou tamponnade : en respiration spontanée, le septum a un mouvement oscillant synchrone avec la fréquence respiratoire, puisqu’il suit les variations alternées du remplissage des deux ventricules en fonction de la pression intrathoracique (voir Péricardite).
De nouvelles modalités échocardiographiques peuvent faciliter le diagnostic de l’ischémie myocardique. La colorisation des déplacements de l’endocarde (ColorKinesis) permet de mieux apprécier le degré de déplacement radiaire de la paroi (Vidéo et Figure 25.38). La déformation (strain), la vitesse de déformation (strain rate) (voir Figure 25.30) et le Speckle-tracking permettent d’affiner la visualisation et la quantification des mouvements segmentaires, et de différencier la contraction active du mouvement passif d'entrainement (Vidéo et Figure 25.31) [3]. Ils mettent bien en évidence le retard de contraction systolique (tardokinésie) et la contraction post-systolique accompagnée d’un retard de relaxation typiques de l’ischémie aiguë (Figure 27.24 et Figure 25.187) [1,13,14].
Vidéo: colorisation des déplacements de l'endocarde en vue court-axe du VG (ColorKinesis).
Vidéo: évaluation différenciée de la contractilité de 6 segments ventriculaires des parois inférieure et antérieure avec la technique de Speckle-tracking (vue 2-cavités).
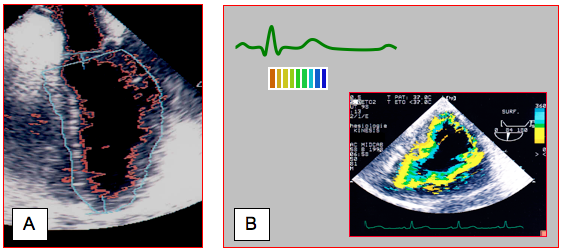
Figure 25.38 : Technologies particulières. A : définition automatique des contours. L’endocarde est représenté en permanence par le trait rouge à l’intérieur de la région d’intérêt (trait bleu). Le processeur calcule en continu la surface délimitée par l’endocarde. B : Color Kinesis™. Une colorisation de la limite sang - tissu synchronisée avec l’ECG met en évidence le degré de déplacement de l’endocarde au cours de la systole.

Figure 25.30 : Doppler tissulaire en cas d'ischémie myocardique. En vue 4-cavités, le septum interventriculaire est divisé en 3 segments (proximal, médian et apical). La vélocité de chacun de ces segments est calculée séparément et la déformation affichée en parallèle. Dans cette illustration, on voit que la contractilité basale est normale, alors que les parties médiane et apicale sont hypokinétiques. S : déformation de l'éjection systolique. FVA: fermeture de la valve aortique. OVA: ouverture de la valve aortique.
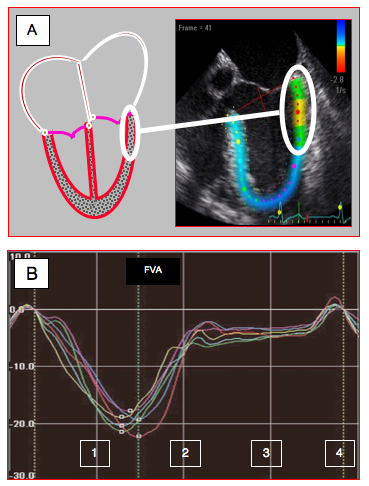
Figure 25.31 : Technologie du speckle-tracking. A: L’inhomogénéité de la structure myocardique permet de suivre les déplacements de petits granules de 20-40 pixels (speckle) présentant une configuration stable au moyen d’algorithmes de reconnaissance de forme ; ces zones se modifiant peu entre la systole et la diastole, on peut les marquer (points de couleur) et quantifier ainsi la cinétique tissulaire indépendamment des mouvements de translation et de rotation du ventricule. Contrairement au Doppler tissulaire, le speckle-tracking est indépendant de l’angle existant entre l’axe du mouvement et celui des ultrasons. Colorisation du VG en fonction de son degré de contractilité (vue 4-cavités 0°) B: division de la paroi du VG en 3 zones (basale, médiane et apicale) sur les parois inférieure et antérieure (vue 2-cavités 90°). C: courbes de déformation longitudinale (strain) obtenues dans 6 segments du VG en vue 2-cavités; chaque segment est représenté par un trait de couleur différente. Dans ce cas, la contraction est homogène. 1: contraction systolique. 2: relaxation. 3: diastasis. 4: contraction auriculaire. FVA: fermeture de la valve aortique [4].

Figure 27.24: Doppler tissulaire et ischémie myocardique; déformation (strain rate) du septum interventriculaire (ETT) ; le segment basal se raccourcit en systole (flèche bleue), alors que le segment apical s’allonge (dyskinésie, flèche rouge) [14].
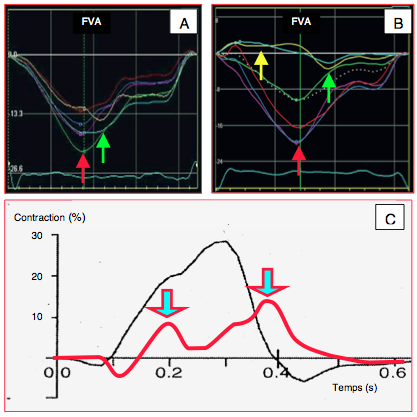
Figure 25.187 : Courbes de déformation longitudinale globale en cas d'ischémie myocardique aiguë. A: contraction post-systolique (flèche verte) dans la zone ischémiée survenant après le pic systolique (flèche rouge) de la paroi ventriculaire normale. Le degré de déformation est nettement diminué dans la zone ischémiée. B: étirement protosystolique (flèche jaune) et contraction postsystolique (flèche verte) dans la zone ischémiée (paroi latérale). Le degré de déformation est quasi-nul dans la zone infarcie (courbes jaune et bleue claire). C: effet d’une occlusion de 5 minutes de l’artère interventriculaire antérieure sur la contraction myocardique locale (courbe rouge) par rapport à la contraction normale (courbe noire). Non seulement le déplacement radiaire de l’endocarde passe de 28% à 13%, mais il change de configuration : la contraction est retardée de 200 ms, et il apparaît un raccourcissement post-systolique qui survient pendant la phase de relaxation isovolumétrique normale [1]. FVA: fermeture de la valve aortique.
Ces techniques sont toutefois difficiles à réaliser en temps réel en salle d’opération. La reconstruction tridimensionnelle des segments du VG est une application récente de la technologie 3D qui facilite l'évaluation des zones ischémiques (Vidéo); elle illustre bien le déplacement radiaire mais non l'épaississement de paroi. Une autre voie possible est l’échocardiographie de contraste. La sonication ultrasonique permet de produire des microbulles de gaz dans des solutés stables comme les perfluorocarbones. Ces microbulles circulent librement dans le lit capillaire et font écho aux ultrasons ; le territoire perfusé apparaît en contraste renforcé sur l'écran. Cette technique permet de visualiser le flux coronaire intramyocardique, de contrôler l’adéquation de la cardioplégie et d’évaluer la perméabilité des greffons. D’importantes difficultés techniques en limitent la portée en peropératoire (voir Chapitre 25 Technologies particulières).
Vidéo: représentation 3D du moulage de l'endocarde du VG au cours d'un cycle cardiaque avec la répartition des 17 segments et l'analyse de leur contractilité individuelle.
Infarctus
La distribution anatomique des troncs coronaires permet de définir les territoires dont la contraction est altérée en fonction du vaisseau obstrué (voir ci-dessus Figure 27.20).
Vidéo: colorisation des déplacements de l'endocarde en vue court-axe du VG (ColorKinesis).
Vidéo: évaluation différenciée de la contractilité de 6 segments ventriculaires des parois inférieure et antérieure avec la technique de Speckle-tracking (vue 2-cavités).
Figure 25.38 : Technologies particulières. A : définition automatique des contours. L’endocarde est représenté en permanence par le trait rouge à l’intérieur de la région d’intérêt (trait bleu). Le processeur calcule en continu la surface délimitée par l’endocarde. B : Color Kinesis™. Une colorisation de la limite sang - tissu synchronisée avec l’ECG met en évidence le degré de déplacement de l’endocarde au cours de la systole.
Figure 25.30 : Doppler tissulaire en cas d'ischémie myocardique. En vue 4-cavités, le septum interventriculaire est divisé en 3 segments (proximal, médian et apical). La vélocité de chacun de ces segments est calculée séparément et la déformation affichée en parallèle. Dans cette illustration, on voit que la contractilité basale est normale, alors que les parties médiane et apicale sont hypokinétiques. S : déformation de l'éjection systolique. FVA: fermeture de la valve aortique. OVA: ouverture de la valve aortique.
Figure 25.31 : Technologie du speckle-tracking. A: L’inhomogénéité de la structure myocardique permet de suivre les déplacements de petits granules de 20-40 pixels (speckle) présentant une configuration stable au moyen d’algorithmes de reconnaissance de forme ; ces zones se modifiant peu entre la systole et la diastole, on peut les marquer (points de couleur) et quantifier ainsi la cinétique tissulaire indépendamment des mouvements de translation et de rotation du ventricule. Contrairement au Doppler tissulaire, le speckle-tracking est indépendant de l’angle existant entre l’axe du mouvement et celui des ultrasons. Colorisation du VG en fonction de son degré de contractilité (vue 4-cavités 0°) B: division de la paroi du VG en 3 zones (basale, médiane et apicale) sur les parois inférieure et antérieure (vue 2-cavités 90°). C: courbes de déformation longitudinale (strain) obtenues dans 6 segments du VG en vue 2-cavités; chaque segment est représenté par un trait de couleur différente. Dans ce cas, la contraction est homogène. 1: contraction systolique. 2: relaxation. 3: diastasis. 4: contraction auriculaire. FVA: fermeture de la valve aortique [4].
Figure 27.24: Doppler tissulaire et ischémie myocardique; déformation (strain rate) du septum interventriculaire (ETT) ; le segment basal se raccourcit en systole (flèche bleue), alors que le segment apical s’allonge (dyskinésie, flèche rouge) [14].
Figure 25.187 : Courbes de déformation longitudinale globale en cas d'ischémie myocardique aiguë. A: contraction post-systolique (flèche verte) dans la zone ischémiée survenant après le pic systolique (flèche rouge) de la paroi ventriculaire normale. Le degré de déformation est nettement diminué dans la zone ischémiée. B: étirement protosystolique (flèche jaune) et contraction postsystolique (flèche verte) dans la zone ischémiée (paroi latérale). Le degré de déformation est quasi-nul dans la zone infarcie (courbes jaune et bleue claire). C: effet d’une occlusion de 5 minutes de l’artère interventriculaire antérieure sur la contraction myocardique locale (courbe rouge) par rapport à la contraction normale (courbe noire). Non seulement le déplacement radiaire de l’endocarde passe de 28% à 13%, mais il change de configuration : la contraction est retardée de 200 ms, et il apparaît un raccourcissement post-systolique qui survient pendant la phase de relaxation isovolumétrique normale [1]. FVA: fermeture de la valve aortique.
Ces techniques sont toutefois difficiles à réaliser en temps réel en salle d’opération. La reconstruction tridimensionnelle des segments du VG est une application récente de la technologie 3D qui facilite l'évaluation des zones ischémiques (Vidéo); elle illustre bien le déplacement radiaire mais non l'épaississement de paroi. Une autre voie possible est l’échocardiographie de contraste. La sonication ultrasonique permet de produire des microbulles de gaz dans des solutés stables comme les perfluorocarbones. Ces microbulles circulent librement dans le lit capillaire et font écho aux ultrasons ; le territoire perfusé apparaît en contraste renforcé sur l'écran. Cette technique permet de visualiser le flux coronaire intramyocardique, de contrôler l’adéquation de la cardioplégie et d’évaluer la perméabilité des greffons. D’importantes difficultés techniques en limitent la portée en peropératoire (voir Chapitre 25 Technologies particulières).
Vidéo: représentation 3D du moulage de l'endocarde du VG au cours d'un cycle cardiaque avec la répartition des 17 segments et l'analyse de leur contractilité individuelle.
Infarctus
La distribution anatomique des troncs coronaires permet de définir les territoires dont la contraction est altérée en fonction du vaisseau obstrué (voir ci-dessus Figure 27.20).
- Lésion de la CD : paroi libre du VD (vue 4-cavité 0° et admission-chasse du VD 60°), paroi postéro-inférieure du VG (vues 2-cavité 90° et transgastrique 0° + 90°), tiers proximal du septum interventriculaire (vue 4-cavité 0°).
- Lésion de la CX : paroi latérale du VG en vues 4-cavité 0° et transgastrique 0° ; dans ces deux vues, les fibres myocardiques sont en majeure partie parallèles à l’axe des ultrasons, ce qui donne peu d’écho en retour ; la paroi paraît peu dense et semble deshabitée, sans que cela représente un signe d’ischémie.
- Lésion de l’IVA : paroi antérieure et apex du VG (vue 2-cavité 90°), paroi antérieure (vues transgastrique 0° et 90°), paroi antéro-septale (4-cavité 0° et long-axe 120°).
L’évaluation de la fonction ventriculaire globale et la mesure de la FE du VG doivent tenir compte des ACS. Les approximations géométriques comme la formule de Teichholz ne sont plus applicables, car elles sont conçues pour une contraction homogène et symétrique du ventricule. Seule la règle de Simpson dans deux plans orthogonaux (voir Chapitre 25, Indices éjectionnels) ou la reconstruction 3D permet une quantification qui prenne en compte la fonction des différentes parois du VG. L’évaluation fonctionnelle doit différencier deux éléments différents.
- La mesure de la fonction globale du VG (FE avec la règle de Simpson) ; celle-ci tient compte des zones akinétiques et dyskinétiques ; sa valeur est abaissée comme celle du débit cardiaque.
- La mesure de la fonction du myocarde valide en excluant les ACS; celle-ci peut se faire par la formule de Teichholz ou la fraction de raccourcissement de diamètre dans les zones saines ; elle est importante pour évaluer la capacité fonctionnelle du myocarde résiduel actif.
L’infarctus du VD, lié à une obstruction de la CD, est en général associé à un infarctus de la paroi inférieure du VG. Le VD se dilate lorsqu’il dysfonctionne parce que sa structure est mince. Sa paroi libre est akinétique ou sévèrement hypokinétique. Sa fonctionnalité doit être mesurée sur cette paroi libre qui, seule, représente la contractilité propre du VD pour trois raisons.
- L’apex échappe à l’akinésie parce qu’il est vascularisé par l’IVA.
- Très richement pourvue de récepteurs béta, la chambre de chasse du VD conserve habituellement une contractilité importante malgré la défaillance du corps du ventricule (Vidéo).
- La chambre d'admission peut conserver une certaine contractilité radiaire parce que ses fibres circulaires sont communes avec celles du VG.
Vidéo: vue admission-chasse du VD 60°; la paroi libre est sévèrement hypokinétique (absence d'épaississement) alors que la chambre de chasse présente encore une contractilité satisfaisante.
L’OD est dilatée et le septum interauriculaire bombe dans l’OG ; en cas de perméabilité du foramen ovale, il s’installe un shunt D → G visible au flux couleur et confirmé par un test aux microbulles. La dilatation du VD entraîne une insuffisance tricuspidienne dont la vélocité maximale (2-2.5 m/s) est inversement proportionnelle au degré de dysfonctionnement du ventricule : la Vmax de l'IT s'abaisse lorsque la force motrice du ventricule diminue.
Dysfonction diastolique
Bien que très précoce, la dysfonction diastolique ne présente pas de modifications spécifiques à l’ischémie, mais est altérée par le défaut de relaxation (voir Chapitre 25, Phases de la diastole) (voir Figure 25.203) [11].
Dysfonction diastolique
Bien que très précoce, la dysfonction diastolique ne présente pas de modifications spécifiques à l’ischémie, mais est altérée par le défaut de relaxation (voir Chapitre 25, Phases de la diastole) (voir Figure 25.203) [11].
- Prolongation de la phase de relaxation isovolumétrique (> 100 ms);
- Diminution de la Vmax du flux protodiastolique E et prolongation de sa phase de décélération (dtE > 250 ms);
- Diminution de la vélocité diastolique de l'anneau mitral (E' 5-8 cm/s);
- Diminution de la vélocité de propagation du flux mitral (< 40 cm/s) (voir Figure 25.199).
Figure 25.203 : Modifications de la vélocité de l’anneau mitral (VAM) selon l'évolution de la dysfonction diastolique, en correspondance avec celles du flux veineux pulmonaire et du flux mitral. Stade I, défaut de relaxation : diminution de la VAM (6-8 cm/s). Stade 2, pseudo-normalisation : VAM 5-6 cm/s, bien que la Vmax E soit normalisée. Stade 3, restriction : la VAM est minime (< 5 cm/s).
Figure 25.199 : Propagation du flux mitral. A : l’axe du flux mitral est dirigé vers la paroi latéro-postérieure et fait un angle d’environ 20° avec le long-axe du VG (pointillé rouge). B : plus le gradient de pression protodiastolique entre l’OG et l’apex du VG est élevé, plus le flux se propage rapidement à l’intérieur du VG. En mode TM couleur, la vélocité de ce flux est mesurable par la pente de la zone d'aliasing (normal : > 50 cm/s). En cas de défaut de relaxation, cette pente diminue; dans le cas présent, elle est de 26 cm/s. Accélérer l'affichage à 100 mm/s rend la mesure plus précise.
Avec l’infarctus et la rigidité imposée par la cicatrice non-contractile, les pressions de remplissage du VG et de l’OG augmentent et les flux présentent une allure restrictive (voir Figure 25.197) :
- Raccourcissement de la phase de relaxation isovolumétrique (< 70 ms);
- Augmentation de la Vmax du flux protodiastolique E et raccourcissement de sa phase de décélération (dtE < 150 ms);
- Effondrement de la vélocité diastolique de l'anneau mitral (E' < 5 cm/s);
- Rapport E/E’ élevé (≥ 15) (voir Figure 25.205C).
Figure 25.197 : Exemples de modifications du flux mitral avec l'agravation de la dysfonction diastolique. A: flux mitral normal. B: défaut de relaxation; le flux E est moins rapide, le flux A est plus important. C: restriction; le flux E est rapide et de courte durée, sa décélération est brève, le flux A est minime.
Figure 25.205 : Méthodes d’évaluation non-invasive d’une élévation de la POG. A: flux veineux puolmonaire normal. B: pente de décélération du flux diastolique D. C: rapport entre la vélocité du flux mitral E au Doppler conventionnel et celle du déplacement de l’anneau mitral E’ au Doppler tissulaire
Le développement d’une dysfonction diastolique restrictive est de mauvais pronostic pour la fonction ventriculaire et pour la survie à long terme [10].
| Evaluation de l’ischémie myocardique |
| L’altération de la cinétique segmentaire (ACS) est définie par 2 éléments : - Diminution de l’épaississement myocardique (normal 25-45% selon les segments) - Diminution du raccourcissement radiaire (normal 25-45%) Gradation : 1- normokinésie, 2 - hypokinésie légère, 3 - hypokinésie sévère, 4 - akinésie, 5 - dyskinésie Les ACS sont recherchées systématiquement dans les 4 quadrants au niveau basal, médio-ventriculaire et apical (vues 4-cavités. 2-cavités, long-axe mi-œsophage et court-axe transgastrique). Les différents quadrants n’ont physiologiquement pas le même degré de contraction. En cas d’ACS, seule la règle de Simpson ou la reconstruction 3D permet d’évaluer la fraction d’éjection. L'infarctus s'accompagne d'une dysfonction systolique et diastolique. |
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- CARR-WHITE GS, LIM E, KOH TW, et al. Regional ventricular dynamics during acute coronary occlusion: a comparison of invasive with non-invasive echocardiographic markers to detect and quantify myocardial ischaemia-observations made during off-pump coronary surgery. Int J Cardiol. 2006; 113:376-84
- CERQUEIRA MD, WEISSMAN NJ, DILSIZIAN V, et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart: Statement for healthcare professionals from the cardiac imaging committee of the Council on clinical cardiology of the American Heart Association. Circulation 2002; 105:539-42
- DUNCAN AD, ALFIREVIC A, SESSLER DI, et al. Peroperative assessment of myocardial deformation. Anesth Analg 2014; 118:525-44
- FEIGENBAUM H, MASTOURI R, SAWADA S. A practical approach to using strain echocardiography to evaluate the left ventricle. Circ J 2012; 76:1550-5
- LANG RM, BADANO LP, MOR-AVI V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: An update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015; 28:1-39
- LANG RM, BADANO LP, TSANG W, et al. EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiography. Eur Heart J Cardiovasc Imaging 2012; 13:1-46
- LORENZ CH, PASTOREK JS, BUNDY JM. Delineation of normal human left ventricular twist throughout systole by tagged cine magnetic resonance imaging. J Cardiovasc Magn Reson 2000; 2:97-108
- MAIER SE, FISCHER SE, McKINNON GC, et al. Evaluation of left ventricular segmental wall motion in hypertrophic cardiomyopathy with myocardial tagging. Circulation 1992; 86:1919-28
- MOLLEMA SA, NUCIFORA G, BAX JJ. Prognostic value of echocardiography after acute myocardial infarction. Heart 2009; 95:1732-45
- MOLLER JE, PELLIKA PA, HILLIS GS, et al. Prognostic importance of diastolic function and filling pressure in patients with acute myocardial infarction. Circulation 2006; 114:438-44
- NAGUEH SF, SMISETH OA, APPLETON CP, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2016; 29:277-314
- ROUINE-RAPP K, IONESCU P, BALEA M, et al. Detection of intraoperative segmental wall-motion abnormalities by transesophageal echocardiography. Anesth Analg 1996; 83:1141-8
- URHEIM S, EDVARDSEN T, TORP H, et al. Myocardial strain by Doppler echocardiography: validation of a new method to quantify regional myocardial function. Circulation 2000; 102:1158-64
- VOIGT JU, ARNOLD MF, KARLSSON M, et al. Assessment of regional longitudinal myocardial strain rate derived from doppler myocardial imaging indexes in normal and infarcted myocardium. J Am Soc Echocardiogr. 2000;13:588-98
27 Echocardiographie, 3ème partie
- 27.1 Evaluation de la volémie
- 27.2 Ischémie myocardique
- 27.3 Cardiomyopathies
- 27.4 Dysfonction ventriculaire
- 27.5 Pathologie péricardique
- 27.6 Masses
- 27.7 Aorte thoracique
- 27.8 Cardiopathies congénitales
- 27.8.1 Introduction
- 27.8.2 Nomenclature anatomique
- 27.8.3 Shunts
- 27.8.4 Pressions droites
- 27.8.5 Fonction ventriculaire
- 27.8.6 Retour veineux et oreillettes
- 27.8.7 Jonction auriculo-ventriculaire
- 27.8.8 Pathologies ventriculaires
- 27.8.9 Jonction ventriculo-artérielle
- 27.8.10 Segment artériel
- 27.8.11 ETO chez les congénitaux
- 27.9 Transplantation et urgences
- 27.10 Chirurgie à coeur battant
- 27.11 Conclusions





























