Step 2 of 2
Physiopathologie du transport d'oxygène
Le DO2
Comme le but premier de la transfusion érythrocytaire est d'améliorer le transport d'O2, il est intéressant de revoir les conditions d'équilibre entre le transport (DO2) et la demande (VO2) en oxygène, et leurs mécanismes compensatoires [1]. Le transport d'O2 est fonction du contenu artériel en O2 (CaO2) et du débit cardiaque (DC):
DO2 = CaO2 • DC
où: CaO2 = (Hb • 1.34 • SaO2) + (0.003 • PaO2)
Si le taux d'Hb est de 150 g/L et la saturation de celle-ci 100%, le contenu artériel en O2 (CaO2) est de 200 ml O2 par litre de sang (20 vol%); il est de 19.5 vol% à l'air ambiant. Pour un débit cardiaque de 5 L/min, le transport d'O2 est de 1'000 mL/min. La consommation en O2 est évaluée par la différence de contenu entre le sang artériel et le sang veineux mêlé (CvO2 = 15 vol%):
VO2 = DC • (CaO2 - CvO2)
La valeur normale est de 5 vol% ou de 250 mL/min. Cette consommation est augmentée en cas de sepsis, d'hyperthermie, de catabolisme accru (brûlés, hyperthyréose), d'effort physique ou de stimulation sympathique. Chez le sujet sain, le transport d'O2 est donc quatre fois supérieur à la consommation de base, ce qui donne une grande marge de sécurité. En effet, l'apport est encore adéquat par rapport à la consommation au repos jusqu'à un taux d'Hb de 45 g/L. Cependant, la VO2 n'est indépendante du transport (DO2) que jusqu'à un point critique (DO2 critique) en dessous duquel elle baisse linéairement avec la diminution du transport (Figure 28.1).
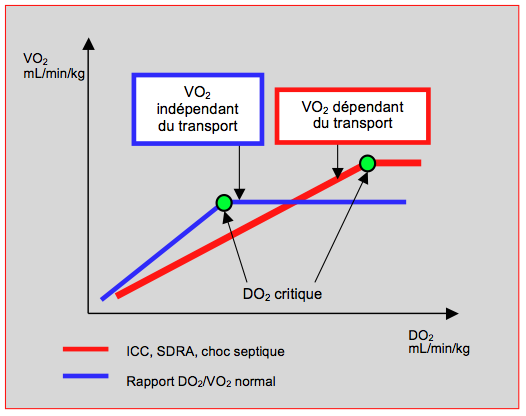
Figure 28.1 : Rapport entre la consommation et le transport d'O2 chez le sujet normal. La courbe bleue représente le sujet normal. La courbe rouge illustre la modification induite par une sepsis: le couplage du transport et de la consommation d’oxygène s’étend sur une plus grande plage de valeurs.
Le coefficient d'extraction d'O2 est la fraction de l'O2 distribué qui est effectivement consommé par les tissus: CeO2 = (CaO2 - CvO2) / CaO2. La valeur normale est de 25%, ce qui signifie que le sang veineux central a un contenu en O2 de 15 vol% et une saturation de 75%. Il s'agit là d'une valeur globale de l'organisme; certains organes comme le coeur ou le cerveau sont plus dispendieux en oxygène que la moyenne; ils extraient donc davantage: 60-70% pour le coeur, 50% pour le cerveau, mais 7-10% pour les reins [6]. Comme il possède le coefficient d'extraction le plus élevé, le coeur est l'organe qui court le plus de risque en cas d'anémie aiguë. Ces données concernent évidemment une perte d'érythrocytes sans perte associée de volume circulant (anémie isovolémique).
Mécanismes compensatoires
En cas d'anémie isovolémique, par exemple lors d'hémodilution peropératoire, plusieurs mécanismes compensatoires se mettent en place pour maintenir adéquat le DO2 jusqu'aux cellules.
- Augmentation du débit cardiaque essentiellement par élévation du volume systolique; comme le sang est un liquide non-newtonien, la baisse de la viscosité qui accompagne la chute de l'Ht affecte davantage le flux là où il est le plus lent, c'est-à-dire dans les veinules postcapillaires; de ce fait, le retour veineux est amélioré, la précharge ventriculaire augmente (augmentation de la PVC et du volume télédiastolique) et le volume systolique est plus élevé [3]. La baisse de la viscosité induit aussi une diminution des résistances périphériques, qui facilite la vidange ventriculaire. Ainsi le DO2 reste constant lorsque l'Ht varie de 45% à 30% [6]; le débit cardiaque est doublé pour un Ht de 20%.
- Augmentation du débit cardiaque par tachycardie; celle-ci est surtout liée à l'hypovolémie, mais elle survient également en normovolémie lors d'hémodilution aiguë; son ampleur est variable selon les espèces. Elle est peu marquée, voir nulle, lors d'hémodilution sous anesthésie générale, où l'augmentation du débit cardiaque dépend essentiellement de l'accroissement du volume systolique [4]. La contractilité et la fonction diastolique ne sont pas modifiées pas l'hémodilution à un Ht de 28% [2].
- Redistribution du débit sanguin: l'autorégulation des organes à haute extraction (cerveau, coeur) leur fournit davantage de débit qu'aux organes à basse extraction (muscle, peau). Le CeO2 du coeur étant déjà voisin de 60% au repos, le débit coronaire doit augmenter de 400-600% pour répondre à la demande. La limite de l'hémodilution isovolémique est atteinte lorsque le coeur ne peut plus accroître son débit ou son flux coronaire. La dilution améliorant les propriétés rhéologiques du sang, le flux est en général augmenté aux travers des sténoses vasculaires, ce qui compense partiellement la baisse du DO2.
- Augmentation de l'extraction d'O2: lorsque l'Ht est inférieur à 25%, les tissus extraient davantage d'O2 (jusqu'à 60%) et la saturation veineuse centrale en O2 s'abaisse à 50% ou au dessous.
- Modification de l'affinité de l'Hb pour l'O2: le déplacement de la courbe de dissociation de l'Hb vers la droite diminue son affinité pour l'O2 et lui permet de le libérer plus facilement. Ceci survient en acidose, en hyperthermie, et en fonction d'une augmentation du taux de 2,3-DPG; la synthèse de ce dernier augmente dès que l'Hb descend en dessous de 90 g/L pendant plus de 36 heures [5].
Une perte de sang aiguë s'accompagne d'une hypovolémie, avec tous les mécanismes qui y sont associés: tachycardie, vasoconstriction, stimulation sympathique, etc. Dans ce document, on n'envisagera que les effets de l'anémie proprement dite, et on considérera que la normovolémie est maintenue. Dans l'anémie chronique, le déplacement de la courbe de dissociation de l'Hb par le 2,3-DPG est le premier mécanisme mis en place, alors que le débit cardiaque ne se modifie pas avant que l'Hb soit inférieure à 80 g/L [6].
| Transport d’oxygène |
|
DO2 = CaO2 • DC
CaO2 = (Hb • 1.34 • SaO2) + (0.003 • PaO2)
VO2 = DC • (CaO2 – CvO2)
Mécanismes compensatoires en cas d’anémie :
- ↑ extraction tissulaire d’O2
- ↑ 2,3 DPG
- ↑ DC par hémodilution (↑ retour veineux)
- ↑ DC par tachycardie (lié à l’hypovolémie)
- Redistribution du DC
|
Références
- HEBERT PC, VAN DER LINDEN P, BIRO G, HU LQ. Physiologic aspects of anemia. Crit Care Clin 2004; 20:187-212
- LICKER M, ELLENBERGER C, SIERRA J, et al. Cardioprotective effects of acute normovolemic hemodilution in patients undergoing coronary artery bypass surgery. Chest 2005; 128:838-47
- LICKER M, ELLENBERGER C, SIERRA J, CHRISTENSON J, et al. Cardiovascular response to acute normovolemic hemodilution in patients with coronary artery diseases: Assessment with transesophageal echocardiography. Crit Care Med 2005; 33:591-7
- SPAHN DR, LEONE BJ, REVES JG, PASCH T. Cardiovascular and coronary physiology of acute isovolemic hemodilution. A review of non-oxygen carrying and oxygen-carryinf solutions. Anesth Analg 1994; 78:1000-21
- STEHLING L, SIMON TL. The red blood cell transfusion trigger: Physiology and clinical studies. Arch Pathol Lab Med 1994; 118:429-36
- TUMAN KJ. Tissue oxygen delivery: the physiology of anemia. Anesthesiol Clin North Am 1990; 8:451-63
28 Transfusions et stratégies d'épargne sanguine en anesthésie cardiaque
- 28.1 Introduction
- 28.2 La transfusion sanguine
- 28.2.1 La transfusion
- 28.2.2 Risques liés à l'administration de produits sanguins
- 28.2.3 Effets de la durée de conservation du sang
- 28.2.4 Impact clinique de la transfusion
- 28.2.5 Risques liés à la déplétion érythrocytaire
- 28.2.6 Critères de transfusion
- 28.2.7 Transfusion massive
- 28.2.8 Transfusion de produits dérivés
- 28.3 Stratégies globales de la gestion du sang
- 28.4 Cas particulier : témoins de Jeovah
- 28.5 Conclusions





























