Step 3 of 9
Stratégies d’anesthésie
Prise en charge anesthésique
La priorité est à la stabilité hémodynamique, car la moindre déviation peut entraîner une décompensation majeure. Même si elle peut paraître excessive en regard de l'opération prévue, la technique d'anesthésie doit être choisie en fonction d’une interférence minimale avec les conditions physiopathologiques et non avec l’idée de faire le plus simple possible (Tableau 12.12).
De ce point de vue, l'anesthésie loco-régionale rachidienne n'est pas moins perturbatrice que l'anesthésie générale. Les conditions du réveil seront assurées selon les besoins. Chez ces malades dont la marge de sécurité est nulle, l'attitude est celle d’une tolérance zéro : toute variation hémodynamique doit être corrigée sans délai en suivant deux principes (Figure 12.30).
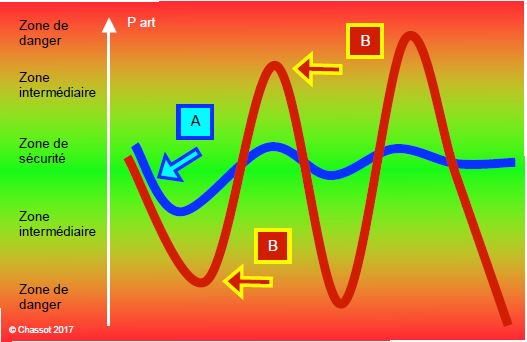
Figure 12.30: Stratégie de maintien d’une donnée physiologique (ici la pression artérielle) selon le double principe de la réaction immédiate et de la sous-correction. Dès que la pression moyenne baisse (courbe bleue), on administre une dose réduite d’agent vasoconstricteur (A) avant même que la pression soit sortie de la zone de sécurité (entre 70 et 90 mmHg, par exemple). La pression se rétablit avec de faibles oscillations. Si l’on attend que la pression soit descendue dans la zone rouge (50 mmHg) et que l’on administre alors une dose importante de vasoconstricteur (B), on assiste à une poussée hypertensive (> 100 mmHg) qui oblige à administrer un hypotenseur ; le bascule vers le haut et vers le bas s’amplifie comme un roulis rythmique, chaque dose de médicament administrée renvoyant le paramètre à l'extrême opposé. De plus, la circulation est très ralentie lors d’épisodes hypotensifs et l'effet du médicament manifeste une forte inertie, faisant courir le risque de donner des doses cumulatives en l’absence de réponse immédiate.
- Réagir immédiatement dès que s'amorce une modification hémodynamique, en suivant les tendances instantanées et non la valeur absolue du chiffre. L'administration d'un hypertenseur, par exemple, se fait dès que la pression commence à diminuer, et non lorsqu'elle a atteint une valeur déjà basse. Lors d’épisodes hypotensifs, la circulation est très ralentie, et l'effet du médicament manifeste une forte inertie, faisant courir le risque de donner des doses cumulatives en l’absence de réponse immédiate; après un délai sans réaction, ceci conduit à une réponse excessive qui bascule dans une poussée hypertensive qu'il faudra combattre avec un vasodilatateur.
- Sous-corriger par rapport au besoin théorique, de manière à éviter l'effet rebond qui crée une sorte de roulis rythmique, chaque dose de médicament administrée renvoyant le paramètre à l'extrême opposé.
On doit jouer sur le volume perfusé (précharge), les amines sympathicomimétiques (effet inotrope) et les substances vasoactives (postcharge) pour stabiliser le débit cardiaque et maintenir la mVO2. Entre plusieurs techniques également applicables, l'anesthésiste choisira celle qu'il (elle) maîtrise le mieux, car les résultats sont toujours meilleurs en suivant une méthode connue avec rigueur et doigté plutôt qu'en improvisant avec une technique que l’on gère mal.
D'une manière générale, l'insuffisance cardiaque amplifie la dépression hémodynamique due aux différents agents d’anesthésie. Même lorsqu’ils sont quasiment dépourvus d'effet inotrope négatif, ceux-ci perturbent la précharge, la postcharge, la fréquence et les baroréflexes de manière significative ; de plus, la ventilation mécanique modifie le régime de pression intrathoracique. Chez l’insuffisant cardiaque, la stratégie est fondée sur les éléments suivants (Tableau 12.12) [2].
- La précharge doit être maintenue mais pas augmentée ; le lit vasculaire est très peu compliant aux variations de volume circulant à cause de l’excès de volume extracellulaire et de la vasoconstriction ; toute augmentation de remplissage menace de dilater le ventricule. D’autre part, le remplissage augmente très peu le volume systolique parce que la courbe de Frank-Starling de l'insuffisant cardiaque est aplatie (voir Figure 12.3). Il est plus efficace de contrôler l’hypotension par des vasoconstricteurs que par des cristalloïdes ou des colloïdes. Toutefois, l’hypovolémie est mal tolérée à cause de la fixité du volume systolique et de la fréquence cardiaque.
- La postcharge ne doit pas s'élever, car la FE est fonction de l'impédance à l'éjection ; la vidange systolique diminue si les résistances montent ; le ventricule dilate et le travail d’éjection augmente (loi de Laplace). La vasodilatation artérielle améliore le débit cardiaque. La limite est le maintien d’une PAM suffisante pour assurer la pression de perfusion coronarienne et la position neutre du septum interventriculaire.
- Seules sont utilisées des substances dont l'effet inotrope négatif est minimal. Par exemple: étomidate, fentanyl, sufentanil, midazolam, isoflurane, sevoflurane, vécuronium, cisatracurium, rocuronium. Le propofol a très peu d’effet inotrope négatif mais baisse considérablement la précharge et la postcharge et bloque la cardio-accélération.
- Les doses des agents d’anesthésie sont réduites. Un bon repère est de ne donner que la moitié du dosage habituel des agents intraveineux ; les halogénés sont maintenus à ≤ 1 MAC.
- L’induction est très lente : il faut attendre le pic d'effet des substances administrées, qui est retardé à cause du ralentissement circulatoire. Le patient élimine lentement les substances administrées (bas débit rénal, stase hépatique).
- Le maintien de l’anesthésie est assuré en « auto-pilote » (halogéné à environ 1 MAC, midazolam en perfusion) de manière à se concentrer sur l’hémodynamique.
- Les déviances hémodynamiques sont corrigées par des agents vasoconstricteurs, vasodilatateurs ou inotropes, mais non par des modifications de la profondeur de l’anesthésie.
- L'effet de la ventilation en pression positive peut être évalué en faisant exécuter une manoeuvre de Valsalva par le patient éveillé lorsque le cathéter artériel est en place ; les variations de la courbe artérielle renseignent sur la manière dont sera tolérée la surpression intrathoracique (faire tenir le Valsalva pendant au moins 20 secondes).
- Maintenir la température par tous les moyens (chauffer la salle et les perfusions, emballer le malade dans du cotton de rembourrage pour plâtre) : l'hypothermie est un des facteurs déterminants des complications cardiaques postopératoires [4]. Les frissons augmentent la VO2 jusqu’à 400% et contraignent à une élévation du DC, donc à une surcharge hémodynamique.
- Maintenir les valeurs hémodynamiques avec un support pharmacologique de manière proactive dès la moindre variation.
- En bolus : éphédrine (5 mg) si baisse de précharge et bradycardie, phényléphrine (100 mcg) si baisse des RAS et tachycardie ; dans l’insuffisance ventriculaire, l’éphédrine perd son efficacité à cause de la déplétion du myocarde en catécholamines endogènes.
- En perfusion : dopamine (2-5 mcg/kg/min, effet alpha excessif par rapport à l’effet béta au-delà de cette dose), dobutamine (2-10 mcg/kg/min), adrénaline (0.01-0.1 mcg/kg/min), milrinone (0.5 mcg/kg/min) ;
- Eviter l’administration de nor-adrénaline (0.01-1.0 mcg/kg/min) seule sans support inotrope ;
- Nitroprussiate en cas de dilatation du VG ; nitroglycérine en cas de dilatation du VD ;
- Les agents inotropes indirects comme l’éphédrine ou la dopamine n’ont pas d’effet lorsque les catécholamines endogènes sont épuisées.
- Maintenir le transport d'oxygène (DO2) en transfusant du sang dès que la concentration d'hémoglobine baisse de 20% de sa valeur initiale ou de sa valeur normale; l’Hb est maintenue à ≥ 100 g/L. Mais la surtransfusion est une surcharge de volume dangereuse.
Des interventions majeures peuvent être courronnées de succès chez des malades en insuffisance ventriculaire pour autant qu’il ne se passe aucun incident ni aucune déviation hémodynamique significative. Ces patients ne sont compensés que dans la situation de base, mais ils ont perdu toute réserve fonctionnelle et toute capacité à tamponner des écarts hémodynamiques (Figure 12.31) [3].
Figure 12.31 : Réduction de la réserve fonctionnelle en rapport avec l'évolution de l’insuffisance ventriculaire. La capacité basale est altérée très progressivement, mais la capacité fonctionnelle maximale est dramatiquement réduite; les patients ont perdu toute faculté d'adaptation aux variations des conditions de charge ou à l'effet inotrope négatif des substances [d’après référence 3].
Il s’agit donc de les maintenir en permanence le plus près possible de leurs conditions de repos et de ne rien leur imposer qui ressemble à un effort, car ni leur volume systolique ni leur débit cardiaque ne peuvent augmenter. D’où une stratégie d’anesthésie proactive fondée sur une correction immédiate de toute déviance hémodynamique et sur une anticipation des problèmes qui pourraient survenir.
Monitorage
Les risques encourus justifient un monitoring invasif, même s'il doit être enlevé dès la salle de réveil (voir Chapitre 6 Monitorage) [2].
- Cathéter artériel : il informe instantanément sur la pression fournie par le VG. Par la forme analogique de la courbe, il renseigne sur la contractilité (dP/dt) et la postcharge (dicrotisme); le volume circulant est illustré par la surface sous la courbe et par les variations respiratoires en ventilation mécanique (ΔPAs > 15% avec un volume courant de 10-12 mL/kg). C'est certainement le monitorage le plus utile et le plus simple ; il est indispensable. L’artère fémorale est plus facile à canuler que la radiale dans les cas instables ; elle présente également l’avantage de mieux refléter la pression aortique: ses valeurs numériques ne sont pas influencées par la vasoconstriction périphérique. De plus, sa forme analogique renseigne sur le flux systolique, le flux diastolique, la performance ventriculaire, la volémie et les RAS (Figure 12.32) [5].
Figure 12.32 : Courbes de pression artérielle. A: Image schématique d’une courbe artérielle dans l’aorte ascendante (ponction peropératoire directe) et dans l’artère fémorale ou radiale (cathéter). La pression systolique enregistrée dans la radiale est plus élevée, mais la diastolique est plus basse ; la pression différentielle (Psyst – Pdiast) est agrandie. La pression moyenne est pratiquement identique dans les trois vaisseaux B: Comparaison de la courbe artérielle lorsque la fonction ventriculaire est normale et lors d’insuffisance ventriculaire gauche; la pente ascentionnelle (dP/dt) est très diminuée, la courbe est arrondie et le dicrotisme relevé; la pression différentielle (PAs – PAd) est très diminuée. La surface sous la courbe systolique (jaune) est proportionnelle au volume systolique. En hypovolémie, la courbe est étroite et la différentielle diminuée; la surface sous la courbe systolique est très rétrécie. C: Aspect analogique de la courbe artérielle en diastole. 1: courbe normale; le flux antérograde diastolique est proportionnel à la surface sous la courbe diastolique (bleue). Dans ce cas, la nor-adrénaline peut être utilisée pour améliorer la pression de perfusion en cas d'hypotension. 2: absence de flux diastolique; la courbe diastolique est pratiquement plate, le flux antérograde est inexistant. Cet aspect est typique de l'hypovolémie; il est une contre-indication à l'utilisation d'un vasopresseur. 3: une perfusion de noradrénaline mise en route dans le cas précédent péjore la situation, car elle induit un flux diastolique rétrograde (flèche) [d'après réf 5].
- Pression de remplissage : la relation entre la pression et le volume télédiastoliques est fonction de la compliance de la cavité cardiaque où se fait la mesure ; comme la courbe de compliance d’un ventricule insuffisant est déplacée vers le haut et vers la gauche, sa pente se redresse et la relation entre la pression et le volume devient plus étroite (voir Figure 12.6B). De ce fait, la mesure de la PVC (insuffisance droite) et de la PAPO (insuffisance gauche) est un indice de remplissage plus fiable chez un patient en insuffisance congestive que chez un individu normal. De plus, la PAPO renseigne sur la pression qui règne au niveau capillaire pulmonaire et permet de ce fait de diriger adéquatement l’apport liquidien. En cas d’insuffisance gauche ou droite, le cathéter pulmonaire de Swan-Ganz est indispensable pour gérer adéquatement l’administration liquidienne dans les situations où les variations de la volémie sont importantes (chirurgie majeure, chirurgie cardiaque).
- Echocardiographie transoesophagienne (ETO): diagnostic anatomique fonctionnel, évaluation de la fonction ventriculaire systolique et diastolique en continu, mesure et surveillance de la taille des ventricules, quantification des effets cardiaques des variations de précharge et de postcharge, détection de l’hypovolémie. Le monitorage échocardiographique permet d’observer l’évolution de l'insufisance mitrale ou tricuspidienne, qui est un bon repère du degré de dilatation et de dysfonction ventriculaire. L’ETO est une technique peu invasive qui apporte un maximum de renseignements en cas d’insuffisance ventriculaire.
- Débit cardiaque : Swan-Ganz (thermodilution), PiCCO (surface sous la courbe artérielle), Doppler oesophagien, NiCCO (principe de Fick sur le CO2 expiré). La mesure du volume systolique est plus intéressante que celle du débit cardiaque, car ce dernier est déjà l’objet d’une correction naturelle par le biais de la fréquence, alors que la volume éjecté est une valeur primaire. Les variations ventilatoires du volume systolique sont un excellent indice de la réponse au remplissage lorsque la fonction ventriculaire est normale, mais sont d’autant moins apparentes que cette dernière est abaissée, parce que la courbe de Starling aplatie du ventricule insuffisant rend son débit peu dépendant des variations de remplissage [7].
Le cathéter pulmonaire de Swan-Ganz est nécessaire à la prise en charge de l’insuffisant cardiaque pour toute chirurgie majeure (chirurgie invasive, chirurgie de l’aorte abdominale, chirurgie cardiaque) parce qu’il mesure la PAP (fonction du VD), la PAPO (risque d’exsudat pulmonaire), le volume systolique et la SvO2, et qu’il calcule le débit cardiaque et les résistances artérielles systémiques et pulmonaires. D’une manière générale, il apporte peu d’information pour évaluer l’hypovolémie, car la courbe de compliance est presque horizontale à bas volume : les variations de volume s’accompagnent de minimes variations de pression. En hypervolémie, au contraire, la courbe de compliance curvilinéaire se redresse et chaque variation de volume se traduit par une modification de pression significative ; la PAPO devient un indice fiable de remplissage (Figure 12.33) [8].
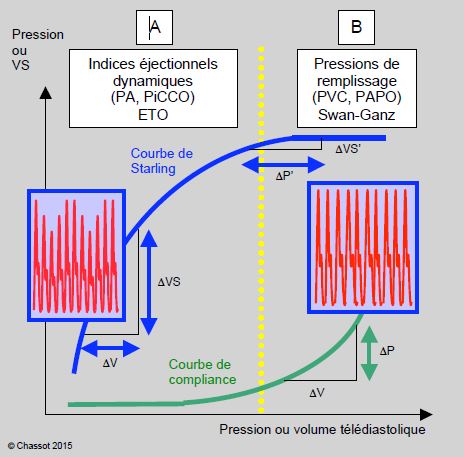
Figure 12.33 : Les deux phases de la courbe de Frank-Starling et de la courbe de compliance déterminent les meilleures techniques de monitorage. Ces deux phases sont séparées par un pointillé jaune vertical. Domaine A : A gauche, en hypovolémie, la courbe de compliance est quasi-plate, mais la courbe de Starling est dans sa phase ascendante ; une variation du volume de remplissage se traduit par une variation non-significative des pressions de remplissages, mais par une variation importante du volume systolique et de la pression artérielle. Ce sont les indices éjectionnels dynamiques (variations ventilatoire de la pression artérielle et du volume systolique VS) ou les mesures indépendantes de la compliance (surfaces des cavités à l’ETO, oscillations du septum interauriculaire) qui sont les plus pertinentes. Domaine B : A droite, en hypervolémie, la courbe de compliance est très redressée, mais la courbe de Starling est horizontale ; une variation du volume de remplissage se traduit par une variation importante des pressions de remplissages, mais par aucune variation du volume systolique ni de la pression artérielle. Ce sont les pressions de remplissage fournies par la Swan-Ganz (PVC, PAPO) qui deviennent utiles. En effet, la relation précharge / volume systolique est bien marquée pendant la phase de recrutement de la courbe de Starling, alors que la relation pression / volume de remplissage n’est significative que pendant la phase de redressement de la courbe de compliance. Le malade en insuffisance gauche congestive est typiquement dans une situation d’hypervolémie chronique.
Le cathéter de Swan-Ganz est globalement indiqué dans trois circonstances :
- Pour régler l'administration liquidienne dans les situations d'hypervolémie et de stase pulmonaire, comme lors d'insuffisance ventriculaire gauche congestive ou de pathologie mitrale ;
- Pour surveiller la circulation pulmonaire en cas de défaillance ventriculaire droite, d'hypertension pulmonaire ou de pathologie pulmonaire (BPCO sévère) ;
- Pour mesurer le débit cardiaque, la PAPO et la SvO2 (adéquation du DC aux besoins de l'organisme).
Dans le cadre de l’insuffisance cardiaque, le PiCCO et les techniques analogues sont moins utiles que la Swan-Ganz, car ils ne fournissent pas d’accès à la PAPO ni à la SvO2. En hypovolémie, on ne retrouve pas d’accentuation des variations ventilatoires de la pression artérielle et du volume systolique chez l’insuffisant cardiaque, car il présente une courbe de Starling très plate [6]. Avec la thermodilution transpulmonaire, toutefois, le PiCCO calcule le volume sanguin intrathoracique et l’eau pulmonaire totale qui sont de bons indices de précharge et d’hypervolémie ; d’autre part, la saturation en O2 dans l’OD (SvcO2) peut remplacer la SvO2, bien que moins fiable. L’administration liquidienne et inotrope gérée en fonction de buts prédéterminés et grâce à des protocoles institutionnels basés sur l’interprétation d’un monitorage précis (goal-directed therapy) est associée à une réduction des complications cardiovasculaires (OR 0.54), des arythmies (OR 0.54) et des épisodes ischémiques (OR 0.70) (voir Chapitre 4, Besoins liquidiens) [1]. Le but est de maintenir constants le débit cardiaque et la SvO2, en jouant sur la précharge, la postcharge et la contractilité en évitant l’improvisation.
| Stratégie d’anesthésie en cas d’insuffisance ventriculaire |
|
Priorité n° 1: stabilité hémodynamique. Quelle que soit l’intervention, la prise en charge est axée sur l’insuffisance ventriculaire, dont découlent l’équipement et la technique d’anesthésie. Une attitude proactive est requise chez ces malades dont la marge de sécurité est nulle: toute déviance hémodynamique doit être corrigée sans délai dès que s'amorce une modification, en suivant les tendances instantanées, non la valeur absolue du chiffre, et en sous-corrigeant de manière à éviter le basculement dans la variation opposée.
- Précharge: restriction liquidienne; le VS augmente peu avec le remplissage (courbe de Starling aplatie); en cas d’hypotension, préférer les
vasoconstricteurs; mais l’hypovolémie est mal tolérée (VS et FC fixes); seuil de transfusion: Hb 90-100 g/L; - Postcharge: maintenue basse; limite: PAM suffisante pour la perfusion coronarienne et la position neutre du septum interventriculaire;
- Induction très lente et dosages réduits;
- Choix de substances ayant le minimum d’interférence hémodynamique (etomidate, fentanyl, sevoflurane/isoflurane, midazolam, propofol très lent);
- Assurer l’anesthésie en auto-pilote pour se concentrer sur l’hémodynamique;
- Corriger les déviances par des agents vasoconstricteurs, vasodilatateurs ou inotropes, non en modifiant la profondeur de l’anesthésie;
- Tolérance à l’IPPV testée avant l’induction par une manoeuvre de Valsalva;
- Maintien de la normothermie (sauf si CEC).
Monitorage: cathéter artériel et ETO, Swan-Ganz pour chirurgie majeure et chirurgie cardiaque. Le cathéter artériel pulmonaire est supérieur aux systèmes de type PiCCO parce qu’il mesure la PAP (fonction du VD), la PAPO (risque d’exsudat pulmonaire) et la SvO2 (adéquation du DC aux besoins).
|
© BETTEX D, CHASSOT PG, Janvier 2008, dernière mise à jour, Novembre 2018
Références
- ARULKUMARAN N, CORREDOR C, HAMILTON MA, et al. Cardiac complications associated with goal-directed therapy in high-risk surgical patients: a meta-analysis. Br J Anaesth 2014; 112:648-59
- BETTEX DA, CHASSOT PG, RUDIGER A. The weak heart: perioperative management. Cardiovasc Medicine 2016; in press
- COOK DJ, ROOKE GA. Priorities in perioperative geriatrics. Anesth Analg 2003; 96:1823-36
- FRANK SM, FLEISHER LA, BRESLOW MJ, et al. Perioperative maintenance of normothermia reduces the incidence of morbid cardiac events. A randomized clinical trial. JAMA 1997; 277:1127-34
- HOSSEINPOUR AR, VAN STEENBERGHE M, BERNATH MA, et al. Improvement in perioperative care in pediatric cardiac surgery by shifting the primary focus of treatment from cardiac output to perfusion pressure: are beta stimulants still needed ? Cong Heart Dis 2017; 12:570-7
- MICHARD F. Changes in arterial pressure during mechanical ventilation. Anesthesiology 2005; 103:419-28
- MICHELAKIS E, TYMCHAK W, LIEN D, et al. Oral sildenafil is an effective and specific pulmonary vasodilator in patients with pulmonary arterial hypertension: Comparison with inhaled nitric oxide. Circulation 2002; 105:2398-403
- SPAHN DR, CHASSOT PG. Con: Fluid restriction for cardiac patients during major noncardiac surgery should be replaced by goal-directed intravascular fluid administration. Anesth Analg 2006; 102:344-6
12 Anesthésie et insuffisance ventriculaire
- 12.1 Introduction
- 12.2 Présentation clinique
- 12.3 Traitement de l'insuffisance ventriculaire
- 12.4 Assistance ventriculaire
- 12.4.1 Principes, indications et physiopathologie
- 12.4.2 Contre-pulsion par ballon intra-aortique (CPIA)
- 12.4.3 Extra-Corporeal Membrane Oxygenation (ECMO)
- 12.4.4 Dispositifs d’assistance ventriculaire à court terme
- 12.4.5 Dispositifs à long terme
- 12.4.6 Problèmes liés à une assistance ventriculaire
- 12.4.7 Rôle de l’échocardiographie dans l’assistance ventriculaire
- 12.4.8 Anesthésie et assistance ventriculaire
- 12.5 Hypertension pulmonaire
- 12.6 Anesthésie en cas d'insuffisance ventriculaire
- 12.6.1 Contraintes
- 12.6.2 Evaluation préopératoire
- 12.6.3 Stratégies d’anesthésie
- 12.6.4 Ventilation et insuffisance ventriculaire
- 12.6.5 Agents intraveineux et halogénés
- 12.6.6 Anesthésie générale du patient en insuffisance ventriculaire gauche
- 12.6.7 Anesthésie loco-régionale
- 12.6.8 Insuffisance droite et hypertension pulmonaire
- 12.6.9 La thrombendartérectomie pulmonaire (TEAP)
- 12.7 Conclusion





























