Step 1 of 1
Contractilité segmentaire
La cinétique de chaque segment du ventricule gauche est une visualisation en temps réel de la performance systolique des trois territoires coronariens, donc un reflet de l'adéquation de leur perfusion. La contraction est caractérisée par deux mouvements : un épaississement et un raccourcissement. Les deux éléments doivent être présents pour que la contraction puisse être qualifiée de normale. En systole, le myocarde s'épaissit de 35 à 45% ; le raccourcissement radiaire est de 25-45% et le raccourcissement longitudinal de 20%. La paroi du VG est divisée en quatre régions, ou portions de cercle: antérieure, latérale, inférieure et septale; en longueur, le ventricule est divisé en trois niveaux: basal, médio-ventriculaire et apical.
- En vue 4-cavités rétrocardiaque à 0°, parois septale et latérale.
- En vue 2-cavités rétrocardiaque à 90°, parois antérieure et inférieure.
- En vue long-axe rétrocardiaque à 120° ; paroi antéro-septale et postérieure.
- En vue transgastrique court-axe à 0°, parois septale, inférieure, latérale et antérieure ; cette incidence visualise les trois territoires coronariens dans leurs segments médio-ventriculaires, mais les deux tiers du VG échappent à cette vue qui ne met en évidence que 17% des altérations de la cinétique segmentaire (ACS) [10].
- L'apex anatomique est visible en 2 cavités à 90° et en long-axe à 120° ; c’est la région la plus difficile à visualiser correctement en ETO ; elle présente un degré d’épaississement supérieur au reste du VG.
Pour affiner cette répartition et correspondre à la vascularisation coronarienne, le VG est divisé en 17 segments: six au niveau basal, six au niveau mi-ventriculaire, quatre au niveau apical et un formant la coiffe apicale. Au niveau basal (segments 1 à 6) et mi-ventriculaire (segments 7 à 12), le pourtour ventriculaire est découpé de la manière suivante.
- 1 et 7: région antérieure;
- 2 et 8: région antéro-septale;
- 3 et 9: région inféro-septale,
- 4 et 10: région inférieure;
- 5 et 11: région inféro-latérale;
- 6 et 12: région antéro-latérale.
Au niveau apical, la paroi n'est divisée qu'en 4 segments parce que le diamètre devient plus étroit.
- 13: région antérieure;
- 14: région septale;
- 15: région inférieure;
- 16: région latérale;
- 17: coiffe apicale (au-delà de la cavité du VG).
La numérotation la plus courante est celle de l'American Heart Association illustrée dans la Figure 25.224 [1,4]. Mais il en existe des variantes à 16 ou 18 segments. D'autre part, certaines publications utilisent une numérotation un peu différente (American Society of Echocardiography) reproduite dans la Figure 25.118 [3].
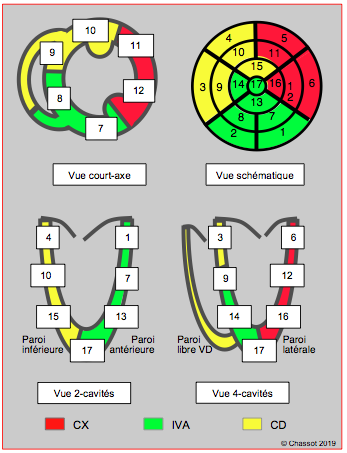
Figure 25.224 : Représentation schématique des différents territoires coronariens vascularisés par chaque tronc artériel dans les coupes échocardiographiques transoesophagiennes habituelles du ventricule gauche (court-axe transgastrique 0°, 2-cavités 90° et 4-cavités 0°). La numérotation commence à la base. Le VG est divisé en trois parties (basale, moyenne, distale) ; la partie apicale est le 17ème segment. Le vue schématique est la représentation en carte polaire centrée sur l'apex avec affichage des 17 segments et des 3 territoires coronariens: coronaire droite (CD) en jaune, circonflexe (CX) en rouge, et interventriculaire antérieure (IVA) en vert [1,4].
La recherche d’altérations de la cinétique segmentaire (ACS) commande obligatoirement de balayer la totalité des différents territoires coronariens et d’y observer le degré de raccourcissement radiaire et d’épaississement de paroi. Il se peut que certains segments aient un déplacement vers le centre dû à la contraction des zones adjacentes, d’où l’importance d’en observer simultanément le degré d’épaississement, et de visualiser chaque région dans plusieurs plans. Les mouvements de translation et de rotation du cœur gênent la lecture des déplacements segmentaires, mais non leur épaississement. Les vues tronquées ou tangentielles induisent en erreur ; il est de la plus haute importance de respecter strictement les plans de coupe standard. Les ACS sont classées en cinq catégories [8].
Figure 25.224 : Représentation schématique des différents territoires coronariens vascularisés par chaque tronc artériel dans les coupes échocardiographiques transoesophagiennes habituelles du ventricule gauche (court-axe transgastrique 0°, 2-cavités 90° et 4-cavités 0°). La numérotation commence à la base. Le VG est divisé en trois parties (basale, moyenne, distale) ; la partie apicale est le 17ème segment. Le vue schématique est la représentation en carte polaire centrée sur l'apex avec affichage des 17 segments et des 3 territoires coronariens: coronaire droite (CD) en jaune, circonflexe (CX) en rouge, et interventriculaire antérieure (IVA) en vert [1,4].
La recherche d’altérations de la cinétique segmentaire (ACS) commande obligatoirement de balayer la totalité des différents territoires coronariens et d’y observer le degré de raccourcissement radiaire et d’épaississement de paroi. Il se peut que certains segments aient un déplacement vers le centre dû à la contraction des zones adjacentes, d’où l’importance d’en observer simultanément le degré d’épaississement, et de visualiser chaque région dans plusieurs plans. Les mouvements de translation et de rotation du cœur gênent la lecture des déplacements segmentaires, mais non leur épaississement. Les vues tronquées ou tangentielles induisent en erreur ; il est de la plus haute importance de respecter strictement les plans de coupe standard. Les ACS sont classées en cinq catégories [8].
- 1 - Normokinésie ; la paroi du VG s’épaissit de 35-45% en systole, le raccourcissement radiaire est > 30%.
- 2 - Hypokinésie légère ; épaississement et raccourcissement radiaire de 10-30% ; correspond à une diminution de 50% du flux coronaire.
- 3 - Hypokinésie sévère ; épaississement et raccourcissement radiaire de ≤ 10% ; correspond à un infarcissement de 20% de l’épaisseur de paroi.
- 4 - Akinésie ; absence d’épaississement, paroi inerte ; diminution du flux coronaire à 5-10% de la norme, infarcissement de > 35% de l’épaisseur de paroi. Si l’aspect structurel de la paroi immobile paraît normal, il se peut que le myocarde puisse récupérer après une revascularisation (hibernation) ; une zone infarcie cicatricielle apparaît au contraire amincie et très échogène (tissu fibreux). Une reprise de la contraction sous perfusion de dobutamine (5-10 mcg/kg/min) est caractéristique d’une zone récupérable, alors qu’une zone infarcie ne réagit pas. La zone immobile peut apparaître plus importante que celle qui est réellement ischémiée à cause de la traction effectuée sur le voisinage par la région akinétique (tethering effect). Une akinésie de la région apicale se traduit typiquement par un apex dilaté et arrondi en vue 2-cavités et long-axe (Figure 25.225).
- 5 - Dyskinésie ; le segment s’expand en systole au lieu de se contracter (mouvement paradoxal) ; l’anévrysme en est un cas particulier.
Figure 25.225 : Akinésie apicale. A et B: akinésie antéro-apicale (flèches rouges); cette zone n'a pas bougé entre la diastole (A) et la systole (B), bien que le diamètre septo-latéral (flèche verte) se soit rétrécit en systole (valve mitrale fermée) grâce au déplacement radiaire adéquat de la paroi latérale et modeste du septum. C: l'apex est dilaté et arrondi (flèches jaunes) en vue long-axe, alors que sa configuration anatomique normale est pointue.
L’addition des points (1 à 5) divisée par le nombre de segments observés permet de construire un score d’ischémie de 1.0 à 3.9, utile pour quantifier les ACS. Il faut un minimum de deux quadrants fonctionnels, même hypokinétiques, pour assurer la survie du patient. L’observation des ACS est compliquée du fait que la contraction du VG est physiologiquement hétérogène (Figure 25.226) [5,7].
- Les quadrants antérieur et latéral ont davantage de course radiaire (35-40%) que les quadrants postérieur (25%) et septal (< 20%) ; ils sont les plus importants pour la performance ventriculaire.
- Ayant une course radiaire de moindre amplitude, la paroi postéro-basale peut paraître hypokinétique alors que sa contraction est physiologique.
- La partie sous-endocardique a davantage de déplacement radiaire que la partie sous-épicardique.
- Le mouvement de torsion systolique est plus marqué à l’apex qu’à la base.
- La contraction des segments basaux propulse davantage de volume que celle des segments apicaux, parce que la cavité y est plus grande. Par contre, la fraction de raccourcissement de surface en court-axe est plus élevée à l'apex qu'à la base, parce qu'elle varie inversement avec la surface télédiastolique, qui est au dénominateur de la fraction.
Figure 25.226 : Raccourcissement radiaire et rotation selon les quadrants du VG. On divise habituellement le VG en 4 quadrants selon le court-axe du ventricule : latéral, antérieur, postérieur et septal. Le degré de contraction est le plus important dans le quadrant latéral, un peu moins marqué dans le quadrant antérieur, et nettement plus faible dans les quadrants postérieur et septal. En particulier, le degré de raccourcissement de la paroi postéro-basale (cercle bleu) est plus faible que le reste du VG, raison pour laquelle elle paraît souvent hypokinétique à l’échocardiographie. Le degré de rotation suit le même dégradé que le raccourcissement ; il est plus important à l’apex qu’à la base et presque nul au niveau du septum [5,7].
Quelques vidéos illustrent des ACS d'origine ischémique: akinésie antéro-apicale, akinésie antérieure, akinésie latérale, IM sur akinésie antérieure (Vidéos).
Vidéo: vue 4-cavités 0° d'une akinésie antéro-apicale majeure sur occlusion de l'IVA; la paroi latérale se contracte mais la partie antéro-apicale reste immobile (le plan 4-cavités coupe la partie distale de la paroi antérieure mais non l'apex anatomique).
Vidéo: vue 2-cavités 90° du même cas d'akinésie antéro-apicale majeure; la partie basale de la paroi antérieure se contracte, mais la partie distale et l'apex sont immobiles. L'apex est arrondi et partiellement anévrysmal.
Vidéo: vue long-axe 120° du même cas d'akinésie antéro-apicale majeure; l'apex et la paroi antéro-septale sont immobiles. La zone hyperéchogène traduit une cicatrice fibreuse.
Vidéo: vue 4-cavités d'une akinésie antérieure sur obstruction de l'IVA; la paroi latérale et la partie basale du septum se contractent, mais tout le territoire antéro-apical est immobile. Le VG est dilaté alors que le VD est de taille normale.
Vidéo: vue 2-cavités 90° d'un cas d'akinésie antérieure étendue; le VG est dilaté, l'apex est arrondi, la paroi antérieure est amincie et immobile.
Vidéo: akinésie latérale suite à une occlusion de l'artère circonflexe.
Vidéo: insuffisance mitrale restrictive due à la déformation du VG par une akinésie antéro-apicale.
Mais les ACS peuvent également apparaître suite à des causes non-ischémiques.
- Hétérogénéité accentuée de la contraction ventriculaire, hypokinésie relative normale de la paroi postéro-basale.
- Mouvements de translation et de rotation du cœur.
- Bloc de branche ou électro-entraînement par un pace-maker.
- Extrasystolie ventriculaire.
- Asynchronisme de la contraction dû à une dilatation ventriculaire.
- Traction effectuée sur la région hypo- ou akinétique par la contraction des segments voisins.
- Dyskinésie du septum interventriculaire lors de l’ouverture du péricarde (modification de l’interdépendance ventriculaire).
- Aplatissement du septum interventriculaire en cas de surcharge ventriculaire droite systolique (hypertension pulmonaire) ou diastolique (surcharge de volume) ; ce phénomène mime une hypokinésie septale.
- Dyskinésie septale (mouvement paradoxal) en cas de surcharge de pression droite due à la désynchronisation de la contraction systolique du VD et du VG.
- Immobilisation basale par une prothèse mitrale.
- Augmentation brusque de postcharge ou baisse soudaine de précharge.
- Sensibilité abaissée lorsque la fonction ventriculaire est mauvaise.
- Image oblique et coupe tronquée ou tangentielle de la paroi.
Dans ces situations, l’observation du degré d’épaississement systolique de la paroi est un critère plus fiable que son déplacement. La présence d'ACS invalide le calcul de la fraction d'éjection (FE) au moyen d'approximations géométriques comme la formule de Teichholz; seule la mesure du volume réel en échocardiographie 3D, ou éventuellement la règle de Simpson sur deux plans orthogonaux, permet de formuler une FE cohérente.
L'ischémie myocardique donne souvent lieu à une insuffisance mitrale dans laquelle les feuillets de la valve sont normaux. La régurgitation est la traduction d'un problème sous-jacent dans le ventricule. Cette IM relève de plusieurs mécanismes (Figure 25.227) [6,12].
L'ischémie myocardique donne souvent lieu à une insuffisance mitrale dans laquelle les feuillets de la valve sont normaux. La régurgitation est la traduction d'un problème sous-jacent dans le ventricule. Cette IM relève de plusieurs mécanismes (Figure 25.227) [6,12].
- Restriction asymétrique de la course systolique des feuillets (IM restritive type IIIb) sur akinésie ou dyskinésie segmentaire de la paroi ventriculaire, entraînant un déplacement latéral et/ou apical d'un muscle papillaire. La tension excessive sur les cordages maintient le feuillet en-dessous du plan de coaptation en systole et la valve fuit obliquement.
- Restriction symétrique sur cardiomyopathie dilatative d'origine ischémique (IM restrictive type IIIb) avec dilatation importante du VG. L'écartement des piliers tire les feuillets dans le ventricule et les maintient en-dessous du plan de coaptation en systole; la fuite mitrale est centrale.
- Bascule d'un ou des feuillets sur rupture ou ischémie papillaire; la rupture partielle ou totale d’un pilier entraîne un basculement de la commissure correspondante dans l'OG en systole (IM type II) et une régurgitation massive (Figure 26.23). La non-contraction d'un muscle papillaire en systole donne trop de longueur aux cordages; le point de coaptation des feuillets est alors éversé dans l'OG (IM type II).
- Dilatation et aplatissement de l'anneau mitral sur akinésie de la paroi inféro- et postéro-basale (IM type I); la dilatation annulaire est asymétrique; elle porte essentiellement sur la partie postérieure de l'anneau car la partie antérieure est fixée au trigone fibreux.
Figure 25.227 : Insuffisance mitrale ischémique. L’IM peut être de type IIIb restrictif (A, B et C), de type II prolapsus (D et E) ou de type I fonctionnel (F). A : akinésie ou dyskinésie segmentaire entraînant le pilier vers l’extérieur et vers l’apex en systole ; le feuillet correspondant est restrictif ; l’IM est excentrique. B : akinésie ou dyskinésie segmentaire entraînant le pilier vers l’extérieur avec une traction excessive sur les codages de 2ème ordre ; ceci se traduit par une image en aile de mouette du feuillet antérieur. < FA : angle du feuillet antérieur à son extrémité avec le plan de l’anneau en systole. C : cardiomyopathie ischémique avec dilatation homogène du VG ; l’IM restrictive est centrale. D : la rupture partielle ou complète d’un pilier provoque un basculemrnt total de la commissure dans l’OG en systole ; on voit un morceau du pilier rompu oscillant au bout des cordages. E : ischémie d’un pilier occasionnant un prolapsus de la commissure correspondante parce que le pilier s’allonge au lieu de se contracter en systole. F : l'ischémie basale cause une dilatation postérieure de l’anneau mitral.
Figure 26.23: Ischémie ou rupture partielle d'un pilier. A. vue bicommissurale; toute la commissure est basculée. B: schéma démontrant la position des piliers axée sur les commissures. MPA: muscle papillaire antérieur. MPP: muscle papillaire postérieur. C1: commissure antérieur. C2: commissure postérieure. C: prolapsus de la commissure antérieure. D: prolapsus de la commissure postérieure.
Le septum interventriculaire peut présenter un mouvement paradoxal sous forme d’une bascule droite-gauche au cours de la systole. Plusieurs origines sont possibles [11].
- Bloc de branche : la désynchronisation fait que le septum ne se contracte pas simultanément avec le reste du ventricule ; il bascule entre la droite et la gauche en fonction de la pression intraventriculaire gauche et de sa propre contraction, qui est tardive.
- Pace-maker : la stimulation du septum est précoce, et sa relaxation a lieu avant la fin de la contraction du reste du VG.
- Péricardotomie : n’étant plus contenu par le péricarde, les ventricules peuvent se dilater ; le septum bascule dans le VD dont la pression baisse.
- Hypertension pulmonaire : comme le pic de pression du VD est plus retardé que normalement par rapport à celui du VG à cause de la postcharge élevée, le septum est d’abord repoussé vers la droite lorsque la pression intraventriculaire gauche est maximale, puis vers la gauche lorsque la pression intraventriculaire droite maximale est atteinte alors que le VG est déjà en protodiastole.
- Surcharge de volume : la dilatation diastolique du VD repousse le septum vers la gauche ; ce dernier reprend sa position en systole.
- Péricardite constrictive ou tamponnade : en respiration spontanée, le septum a un mouvement oscillant synchrone avec la fréquence respiratoire, puisqu’il suit les variations de remplissage des deux ventricules en fonction de la pression intrathoracique (voir Chapitre 16 Interactions cardio-respiratoires).
De nouvelles modalités échocardiographiques peuvent faciliter le diagnostic de l’ischémie myocardique. La colorisation des déplacements de l’endocarde (ColorKinesis) permet de mieux apprécier le degré de déplacement radiaire de la paroi (Vidéo et Figure 25.38). La déformation (strain) et la vitesse de déformation (strain rate) par le Doppler tissulaire ou par la technique de speckle-tracking permettent d’affiner la visualisation et la quantification des mouvements segmentaires, et de différencier la contraction active du mouvement passif d'entrainement; elles discriminent entre l'occlusion coronaire (hypokinésie segmentaire) et la lésion d'ischémie-reperfusion (hypokinésie globale, sidération) après la revascularisation (Vidéo et Figure 25.30) [2].
Vidéo: technologie de ColorKinesis; le déplacement concentrique au cours de la systole est coloré selon une échelle allant de l'orange au bleu et indiquant la position de l'endocarde au cours de la systole.
Vidéo: vue long-axe du VG en speckle-tracking; chaque paroi est divisée en 3 segments dont le degré de contraction est évalué de manière indépendante. Cette technique permet une appréciation fine et quantitative de la contractilité segmentaire en cas d'ischémie myocardique.
La déformation segmentaire (segmental strain) est typiquement abaissée à < 14% dans les segments ischémiques; une déformation > 21% exclut pratiquement une maladie coronarienne, alors qu'une déformation < 4% est suspecte de non-viabilité [9]. Ils mettent bien en évidence le retard de contraction systolique (tardokinésie) et la contraction post-systolique accompagnée d’un retard de relaxation typiques de l’ischémie aiguë (voir Figure 25.187) [13]. Ces techniques sont toutefois difficiles à réaliser en temps réel en salle d’opération. La reconstruction tridimensionnelle des segments du VG est une application récente de la technologie 3D qui facilite l'évaluation des zones ischémiques (Vidéo et Figure 25.144C).
Vidéo: moulage 3D de l'endocarde du VG avec sa division en 17 segments dont la contractilité est suivie en continu au cours du cycle cardiaque; la déformation systolo-diastolique de chaque segment est illustrée par les courbes colorées au bas de l'écran.
Une autre voie possible est l’échocardiographie de contraste. La sonication ultrasonique permet de produire des microbulles de gaz dans des solutés stables comme les perfluorocarbones. Ces microbulles circulent librement dans le lit capillaire et font écho aux ultrasons ; le territoire perfusé apparaît en contraste renforcé sur l'écran. Cette technique permet de visualiser le flux coronaire intramyocardique, de contrôler l’adéquation de la cardioplégie et d’évaluer la perméabilité des greffons. D’importantes difficultés techniques en limitent la portée en peropératoire (voir Figure 25.40B).
Des informations complémentaires à l’examen ETO en cas d’ischémie myocardique, y compris les complications décelables à l'échocardiographie, sont mentionnées au Chapitre 27, Ischémie myocardique.
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
Vidéo: technologie de ColorKinesis; le déplacement concentrique au cours de la systole est coloré selon une échelle allant de l'orange au bleu et indiquant la position de l'endocarde au cours de la systole.
Vidéo: vue long-axe du VG en speckle-tracking; chaque paroi est divisée en 3 segments dont le degré de contraction est évalué de manière indépendante. Cette technique permet une appréciation fine et quantitative de la contractilité segmentaire en cas d'ischémie myocardique.
La déformation segmentaire (segmental strain) est typiquement abaissée à < 14% dans les segments ischémiques; une déformation > 21% exclut pratiquement une maladie coronarienne, alors qu'une déformation < 4% est suspecte de non-viabilité [9]. Ils mettent bien en évidence le retard de contraction systolique (tardokinésie) et la contraction post-systolique accompagnée d’un retard de relaxation typiques de l’ischémie aiguë (voir Figure 25.187) [13]. Ces techniques sont toutefois difficiles à réaliser en temps réel en salle d’opération. La reconstruction tridimensionnelle des segments du VG est une application récente de la technologie 3D qui facilite l'évaluation des zones ischémiques (Vidéo et Figure 25.144C).
Vidéo: moulage 3D de l'endocarde du VG avec sa division en 17 segments dont la contractilité est suivie en continu au cours du cycle cardiaque; la déformation systolo-diastolique de chaque segment est illustrée par les courbes colorées au bas de l'écran.
Une autre voie possible est l’échocardiographie de contraste. La sonication ultrasonique permet de produire des microbulles de gaz dans des solutés stables comme les perfluorocarbones. Ces microbulles circulent librement dans le lit capillaire et font écho aux ultrasons ; le territoire perfusé apparaît en contraste renforcé sur l'écran. Cette technique permet de visualiser le flux coronaire intramyocardique, de contrôler l’adéquation de la cardioplégie et d’évaluer la perméabilité des greffons. D’importantes difficultés techniques en limitent la portée en peropératoire (voir Figure 25.40B).
Des informations complémentaires à l’examen ETO en cas d’ischémie myocardique, y compris les complications décelables à l'échocardiographie, sont mentionnées au Chapitre 27, Ischémie myocardique.
| Evaluation de l’ischémie myocardique |
| L’altération de la cinétique segmentaire (ACS) est définie par 2 éléments : - Diminution de l’épaississement myocardique (normal 25-40% selon les segments) - Diminution du raccourcissement radiaire (normal 25-40%) Gradation : 1- normokinésie, 2 - hypokinésie légère, 3 - hypokinésie sévère, 4 - akinésie, 5 - dyskinésie Les ACS sont recherchées systématiquement dans les 4 quadrants au niveau basal, médio-ventriculaire et apical (vues 4-cavités, 2-cavités, long-axe mi-œsophage et court-axe transgastrique). Les différents quadrants n’ont normalement pas le même degré de contraction. |
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
- CERQUEIRA MD, WEISSMAN NJ, DILSIZIAN V, et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart: Statement for healthcare professionals from the cardiac imaging committee of the Council on clinical cardiology of the American Heart Association. Circulation 2002; 105:539-42
- DUNCAN AD, ALFIREVIC A, SESSLER DI, et al. Peroperative assessment of myocardial deformation. Anesth Analg 2014; 118:525-44
- LANG RM, BIERIG M, DEVEREUX RB, et al. Recommendations for chamber quantification: A report from the ASE’s Guidelines and Standards Committee and the Chamber Quantification writing group, developped in conjunction with the EAE, a branch of the ESC. J Am Soc Echocardiogr 2005; 18:1440-63
- LANG RM, BADANO LP, MOR-AVI V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: An update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015; 28:1-39
- LORENZ CH, PASTOREK JS, BUNDY JM. Delineation of normal human left ventricular twist throughout systole by tagged cine magnetic resonance imaging. J Cardiovasc Magn Reson 2000; 2:97-108
- MAGNE J, SENECHAL M, DUMESNIL J, PIBAROT P. Ischemic mitral regurgitation: A complex multifactorial disease. Cardiology 2009; 112:244-59
- MAIER SE, FISCHER SE, McKINNON GC, et al. Evaluation of left ventricular segmental wall motion in hypertrophic cardiomyopathy with myocardial tagging. Circulation 1992; 86:1919-28
- MATHEW JP, SWAMINATHAN M, AYOUB CM. Clinical manual and review of transesophageal echocardiography, 2nd edition. New York: McGraw-Hill 2010, 571-89
- POTTER E, MARWICK TH. Assessment of left ventricular function by echocardiography. The case for routinely adding global longitudinal strain to ejection fraction. JACC Cardiovasc Imaging 2018; 11:260-74
- ROUINE-RAPP K, IONESCU P, BALEA M, et al. Detection of intraoperative segmental wall-motion abnormalities by transesophageal echocardiography. Anesth Analg 1996; 83:1141-8
- SANZ J, SANCHEZ-QUINTANA D, BOSSONE E, et al. Anatomy, function, and dysfunction of the right ventricle. J Am Coll Cardiol 2019; 73:1463-82
- SHAKIL O, JAINANDUNSING JS, ILIC R, et al. Ischemic mitral regurgitation: an intraoperative echocardiographic perspective. J Cardiothorac Vasc Anesth 2013; 27:573-85
- URHEIM S, EDVARDSEN T, TORP H, et al. Myocardial strain by Doppler echocardiography: validation of a new method to quantify regional myocardial function. Circulation 2000; 102:1158-64
25. Echocardiographie transoesophagienne 1ère partie
- 25.1 Introduction
- 25.2 Principes physiques de l'échocardiographie
- 25.3 Anatomie fonctionnelle
- 25.3.1 Technique et risques de l'ETO
- 25.3.2 Examen standard 2D
- 25.3.3 Examen des valves
- 25.3.4 Examen bidimensionnel des ventricules
- 25.3.5 Examen des oreillettes
- 25.3.6 Mode TM
- 25.3.7 Examen Doppler
- 25.3.8 Examen tridimensionnel (3D)
- 25.3.9 Mesures quantitatives
- 25.3.10 Examen rapide
- 25.3.11 Images artéfactuelles
- 25.3.12 Rapport d'examen
- 25.4 Mesures hémodynamiques
- 25.5 Fonction systolique du VG
- 25.6 Fonction diastolique du VG
- 25.7 Fonction ventriculaire droite
- 25.8 Fonction ventriculaire segmentaire
- 25.9 Insuffisance cardiaque
- 25.10 Place de l'ETO en clinique
- 25.11 ETO en chirurgie cardiaque
- 25.12 ETO en chirurgie non-cardiaque
- 25.13 Echocardiographie en soins intensifs
- 25.14 Echocardiographie au déchocage
- 25.15 Echocardiographie transthoracique
- 25.16 Conclusions





























