Step 3 of 3
Techniques de cardioplégie
Malgré un demi-siècle de recherche sur la cardioplégie, la solution idéale n’est toujours pas trouvée. Il existe donc de nombreuses variations dans ces perfusats.
- Solution cristalloïde hyperkalémique et hypotherme (5-10°);
- Sang additionné de solution potassique;
- Cardioplégie au sang hypotherme ou normotherme;
- Perfusion intermittente ou continue;
- Addition de substrat métabolique: glucose, acides aminés, ATP;
- Addition d’agents protecteurs.
Le but d’une cardioplégie est de remplir six exigences physiologiques: l'arrêt cardiaque immédiat, le frein du métabolisme, l'apport de substrat, le maintien du pH, la prévention de l'oedème, et la prévention des lésions de reperfusion [3]. Remplir ces missions demande des techniques différentes selon le contexte. Il est plus judicieux d'adapter la cardioplégie à la situation propre du malade que de se restreindre à une seule solution en toutes circonstances [9].
Solutions cristalloïdes
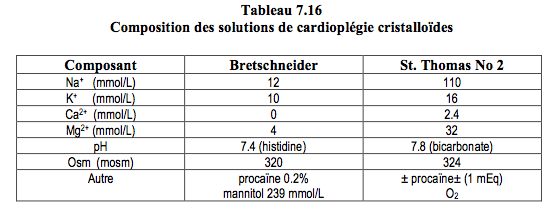
La solution de cardioplégie cristalloïde est la plus simple et la moins coûteuse; elle est efficace dans les cas standard. Les solutions les plus utilisées sont de type extracellulaire enrichies en potassium et pauvres en calcium, comme la solution de St. Thomas (Tableau 7.16) [5]. D’autres solutions miment la composition intracellulaire (basses en sodium et sans calcium), comme la solution de Bretschneider ou la solution HKT Custodiol™ ; elles sont aussi utilisées pour la préservation d'organes en transplantation. On ajoute habituellement du magnésium pour diminuer l'augmentation de [Ca2+]i que provoque l'hyperkaliémie. L'avantage de la cardioplégie cristalloïde est la clarté du champ opératoire pour le chirurgien et la rhéologie favorable pour atteindre des zones distales à des obstructions coronariennes serrées, mais le désavantage est l'impossibilité de transporter de l'oxygène et le risque d'hémodilution [2]. Elle est de plus en plus remplacée par la cardioplégie au sang.
Les solutions sont administrées par une pompe séparée du circuit de CEC (Figure 7.13) sous une pression d'environ 70-150 mmHg et un débit de 200-300 mL/min pendant au moins 2 minutes, car il faut 2 mL de solution par gramme de coeur, soit environ 500 mL pour un adulte. Pour l’entretien de l’arrêt, il suffit de répéter la perfusion toutes les 30 minutes avec un débit de 150 mL/min pendant 1-2 minutes. La température est de 5-10°. Par voie rétrograde, la pression de perfusion est de 20-30 mmHg environ, avec une valeur maximale de 40 mmHg.
Une modification de la cardioplégie cristalloïde consiste à administrer un petit volume d'une solution hautement concentrée [2]. Ces très fortes concentrations, notamment en en K+, sont possibles parce que la quantité perfusée représente approximativement le volume de l'arbre coronarien; la majeure partie de la solution reste donc dans le cœur et ne se déverse pas dans la circulation générale. Ce petit volume ne permet pas des échanges thermiques significatifs; la protection, d'une durée de 30-60 minutes, est assurée par la composition de la solution mais non par l'hypothermie.
- Custodiol™, solution hyperkaliémique pauvre en Na+ et en Ca2+ mais additionnée d’histidine, de kéto-glutarate et de mannitol, administrée en une seule dose de 5 mL/kg en 7-10 minutes.
- Cardioplexol™, solution hyperkaliémique (100 mmol/L) et hypermagnésémique (162 mmol/L) additionnée de xylitol, d'acide citrique et de procaïne; elle se donne en un bolus de 100 mL, ce qui représente 10 mmol de K+, 16.2 mmol de Mg2+ et 300 mg de procaïne; elle protège le cœur pour 45 minutes, quelle que soit la température.
Cardioplégie au sang
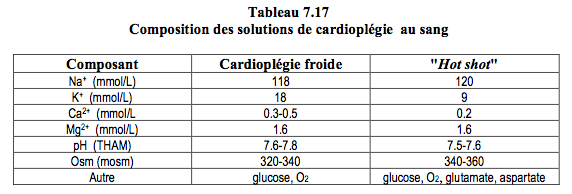
Le sang artériel prélevé sur le circuit de CEC par une pompe séparée est additionné d'une solution électrolytique riche en potassium dans une proportion solution/sang de 1/5. Il traverse un échangeur thermique indépendant (Figure 7.13). C’est un perfusat alcalin (pH ≥ 7.6) et hyperosmolaire (≥ 330 mOsm), contenant 20-25 mmol/L de potassium et peu de calcium (≤ 1 mmol/L) (Tableau 7.17). On profite ainsi de la capacité du sang à transporter de l'oxygène, de son pouvoir tampon, et de ses qualités rhéologiques, oncotiques et antagonistes des radicaux libres. L'histidine des protéines du plasma fournit la majeure partie du pouvoir tampon, efficace quelle que soit la température. La cardioplégie au sang hypotherme est actuellement la technique de cardioplégie la plus fréquemment utilisée [8].
Comparée à la solution cristalloïde, la cardioplégie au sang donne de meilleurs résultats, notamment dans les cas à risque élevé: meilleure reprise fonctionnelle, diminution des lésions ischémiques, reprise du rythme sinusal spontané plus fréquente, meilleure préservation des réserves d'ATP [6]. Il n'y a toutefois pas de diminution du taux d'infarctus ni de mortalité [8].
Une variation dans la proportion solution/sang consiste à injecter par une pompe-seringue (à 45 mL/h) une solution cardioplégique concentrée contenant 16 mmol/L de KCl et 3 mmol/L de Mg2+ dans un débit de sang pris sur la ligne artérielle de CEC, dont la température est > 30°C. Cette technique dite de Calafiore limite le degré d’hémodilution [4].
La cardioplégie au sang peut être administrée sous trois températures différentes [1,6,7].
- L'arrêt est en général induit par une perfusion froide (5-10°C) de 2-4 minutes à 200-300 mL/min et sous une pression de 60-150 mmHg; le maintien de l'immobilité mécanique est assuré par des perfusions itératives à 150 mL/min. Les températures basses améliorent la protection et permettent un temps d'arrêt entre les perfusions (30-40 minutes), mais les lésions de reperfusion restent très importantes.
- On peut utiliser exclusivement une perfusion de cardioplégie au sang normothermique, mais elle doit rester continue ou réitérée toutes les 10 minutes. Si la distribution intramyocardique est inadéquate (cardiopathie hypertrophique, coronaropathie sévère), le coeur est alors exposé à des lésions ischémiques parce que le métabolisme n'est pas freiné. Par rapport à la cardioplégie froide, la cardioplégie "chaude" tend à améliorer la fonction ventriculaire postopératoire et à diminuer les marqueurs ischémiques (troponines, CK-MB), essentiellement dans les cas où elle peut rester continue pendant toute l'intervention.
- Un compromis est recherché dans une température intermédiaire tiède (27-30°C), qui s'est révélée efficace pour la protection myocardique et qui atténue les lésions de reperfusion.
- Avant la revascularisation, une perfusion de cardioplégie normothermique (hot shot) pendant 2-3 minutes à 60 mmHg, diminue les lésions de reperfusion.
Substances ajoutées
Les solutions de cardioplégie doivent être légèrement hyperosmolaires pour diminuer l'oedème, légèrement alcalines pour freiner l'acidose lactique, et contenir peu de calcium pour minimiser l'accumulation calcique intra-mitochondriale. De nombreux additifs sont utilisés pour remplir ces fonctions.
- Tampon: Tris, THAM, histidine (le bicarbonate perd son effet tampon à froid);
- Agents hyperosomolaires (mannitol, albumine, colloïde);
- Magnésium, stéroïde, procaïne;
- ATP, glucose;
- Agents anti-oxydants.
Rappelons que le préconditionnement par les agents halogénés (isoflurane, sevoflurane et desflurane à 1-2 MAC) pendant la durée de l’opération améliore la tolérance du myocarde à l'ischémie.
| Techniques de cardioplégie |
|
Les techniques de cardioplégie peuvent être réparties en deux groupes:
- Solutions cristalloïdes hyperkaliémique et hypothermes
- Cardioplégie au sang, avec addition de K+; avantages: apport d’O2 et d’ATP, tampon (valance histidine)
L’arrêt est provoqué par une hyperkaliémie, en général froide (5-10°C). Une solution de sang normotherme permet de réduire les lésions de reperfusion mais doit être continue.
De nombreuses substances peuvent être ajoutées selon les protocoles.
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour, Décembre 2019
Références
- ABAH U, ROBERTS PG, ISHAQ M, et al. Is cold or warm cardioplegia superior for myocardial protection ? Interact CardioVasc Thorac Surg 2012 ; 14 :848-55
- ANGELI E. The crystalloid cardioplegia: advantages with a word of caution. Ann Fr Anesth Réan 2011; 30:S17-S19
- BUCKBERG GD. Strategies and logic of cardioplegic delivery to prevent, avoid and reverse ischemic and reperfusion damage. J Thorac Cardiovasc Surg 1987; 93:127-35
- CALAFIORE AM, TEODORI G, MEZZETTI A, ET AL. Intermittent antegrade warm blood caredioplegia. Ann Thorac Surg 1995; 59:398-402
- CHAMBERS DJ, SAKAI A, BRAIMBRIDGE MV, et al. Clinical validation of St. Thomas's Hospital cardioplegic solution No. 2 (Plegisol). Eur J Cardiothorac Surg 1989; 3:346-52
- DECOENE C. La cardioplégie sanguine: avantages et inconvéniuents. Ann Fr Anesth Réan 2011; 30:S20-S22
- FAN Y, ZHANG AM, XIAO YB, et al. Warm versus cold cardioplegia for heart surgery: A meta-analysis. Eur J Cardiothorac Surg 2010; 37:912-9
- JACOB S, KALLIKOURDIS A, SELKE F, DUNNING J. Is blood cardioplegia auperior to crystalloid cardioplegia ? Interact CardiioVasc Thor Surg 2008; 7:491-9
- KUNST G, MILOJEVIC M, BOER C, et al. 2019 EACTS/EACTA/EBCP guidelines on cardiopulmonary bypass in adult cardiac surgery. Br J Anaesth 2019; 123:713-57
07. La circulation extra-corporelle
- 7.1 Introduction
- 7.2 Machines et circuits de CEC
- 7.2.1 Schéma général
- 7.2.2 Liquide d’amorçage et hémodilution
- 7.2.3 Drainage et réservoir veineux
- 7.2.4 Oxygénateur
- 7.2.5 Echangeur thermique
- 7.2.6 Pompes
- 7.2.7 Circuit artériel et filtre
- 7.2.8 Aspiration
- 7.2.9 Circuit de cardioplégie
- 7.2.10 Drainage du VG (venting)
- 7.2.11 Hémofiltration
- 7.2.12 Mini - CEC
- 7.2.13 Anticoagulation en CEC
- 7.2.14 Agents antifibrinolytiques
- 7.3 Physiopathologie de la CEC
- 7.3.1 Caractéristiques
- 7.3.2 Aspects hématologiques
- 7.3.3 Syndrome inflammatoire systémique (SIRS)
- 7.3.4 Hémodynamique
- 7.3.5 Hypothermie
- 7.3.6 Embolies gazeuses
- 7.3.7 Bilan hydrique et métabolique
- 7.3.8 Fonction cérébrale
- 7.3.9 Fonction rénale
- 7.3.10 Fonction hépato-splanchnique
- 7.3.11 Fonction pulmonaire et ventilation en CEC
- 7.4 Pharmacologie de la CEC
- 7.5 Déroulement de la CEC
- 7.6 Sevrage de la CEC
- 7.6.1 Sortie de pompe
- 7.6.2 Purge des cavités gauches
- 7.6.3 Préparation à la mise en charge
- 7.6.4 Mise en charge
- 7.6.5 Période post-CEC immédiate
- 7.6.6 Décanulation et administration de protamine
- 7.6.7 Hémostase et coagulation
- 7.6.8 Arythmies post-CEC et entraînement électro-systolique
- 7.6.9 Insuffisance ventriculaire après CEC
- 7.7 Protection myocardique et CEC
- 7.8 Incidents et accidents
- 7.9 CEC hors chirurgie cardiaque
- 7.10 Conclusions





























