Step 2 of 5
Imagerie 2D et 3D de la sténose aortique
L'acquisition et la description des images normales de la valve aortique en vues mi-oesophagiennes et transgastriques ont déjà été traitées à propos de l'insuffisance aortique (voir Imagerie 2D et 3D, ETO de la valve aortique normale). Quatre vues sont disponibles pour visualiser la valve aortique en ETO (voir Figures 26.69 et 26.70) :
- Vue court-axe 40° mi-œsophage;
- Vue long-axe 120-140° mi-œsophage;
- Vue 4-5 caavités 0° transgastrique profond;
- Vue long-axe 120° transgastrique.
En systole, la surface d’ouverture normale de la valve est 3-4 cm2. En vue long axe, la position des cuspides est pratiquement parallèle au flux sanguin. Leur écartement est de 2.0 – 2.5 cm et la distance à la paroi des sinus de Valsalva est de 2-3 mm ; un accolement à la paroi des sinus ferait courir un risque de retard à la fermeture en début de diastole. En diastole, la hauteur de coaptation des cuspides est de 4-8 mm. Les dimensions normales de la racine aortique, mesurées en systole et à la limite interne (inner edge to inner edge), sont les suivantes (vue long axe mi-œsophage 120°) (voir Figure 26.73 et Tableau 26.5) [4,11] :
- Diamètre de la chambre de chasse (3-5 mm en amont de la valve aortique) : 18 – 24 mm.
- Diamètre de l’anneau aortique : 18-25 mm (1.3 cm/m2); ce diamètre, mesuré aux points d’articulation des feuillets, définit la taille des prothèses mécaniques et biologiques montées. Le diamètre de l’anneau aortique tel qu’on le mesure en vue long-axe 120° à l’ETO est légèrement plus étroit que le diamètre anatomique réel, parce qu’il ne passe pas exactement par le centre de l’anneau, mais un peu postérieurement à celui-ci (voir Figure 26.71).
- Diamètre des sinus de Valsalva : 21-39 mm (1.7 cm/m2).
- Jonction sino-tubulaire : 20-34 mm (1.5 cm/m2); ce diamètre ne doit pas différer de > 10% de celui de l’anneau aortique pour permettre l’implantation d’une valve biologique sans monture (stentless).
- Distance anneau aortique – jonction sino-tubulaire : 20-25 mm.
- Distance anneau – ostium coronaire droit: 15 mm.
- Longueur des cuspides: 12 mm.
- Ecartement des cuspides: 20-25 mm.
- Diamètre de l’aorte ascendante au niveau du croisement de l’artère pulmonaire droite: 22-35 mm (1.5 cm/m2); cette mesure est la seule faite en diastole.
La mesure de l’anneau aortique en long-axe de l’aorte ascendante (120°) peut devenir difficile lorsque la valve est très calcifiée, parce que les amas calciques font des cônes d’ombre qui masquent les structures distales. Alors que la partie postérieure de l’anneau, qui est proche du capteur, est bien identifiable, sa partie antérieure est indiscernable. Ce n’est qu’en observant l’image en mouvement que l’on peut identifier le point où le feuillet s’articule avec l’anneau.
La surface d’ouverture de la valve aortique change de forme au cours de la systole (voir Figure 26.72). En protosystole, elle est circulaire pendant un court instant, puis elle prend la forme d’un triangle isocèle pendant plus des deux tiers de la durée d’éjection et se referme en télésystole sous forme d’une étoile de mer à 3 branches [6]. Pour la mesure du volume systolique (VS = S • ITV), il est recommandé d’utiliser la forme triangulaire calculée entre les 3 commissure en court axe 40° (Vidéo) [3].
Vidéo: valve aortique normale en vue court-axe 40°; la valve change de forme au cours de la systole.
Vues ETO 2D de la sténose aortique
La valve aortique est située dans un plan à 40° par rapport au plan horizontal ; l’axe de l’aorte ascendante est à environ 130°. Une sténose aortique entraîne une hypertrophie concentrique du VG et une ectasie avec déroulement de l’aorte post-sténotique. Ce remodelage modifie l’axe CCVG – racine de l’aorte ; il devient plus horizontal. En se déroulant, l’aorte ascendante empiète sur l’OD et peut apparaître en surplomb de celle-ci en vue 4-cavités (Figure 26.100).
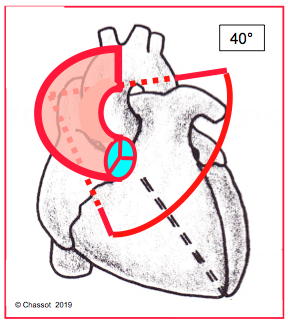
Figure 26.100 : Position spatiale de la valve aortique. Son court-axe est dans un plan à 40° (rouge) par rapport au plan horizontal du thorax [2]. La silhouette rouge indique le déroulement de l’aorte ascendante lors de sténose aortique ; l’aorte empiète sur la partie supérieure de l’OD.
L'image de la sténose aortique est caractéristique: le mouvement des cuspides est restreint par la rigidité, les calcifications ou les fusions commissurales. En vue long-axe, elles sont déformées en dôme ou en crochet; lorsque leur espacement en systole est ≤ 6 mm, la sténose est sévère. En vue court-axe, l'orifice ressemble à une étoile à trois branches. La forte échogénicité du calcium rend la définition des structures souvent difficile à cause des réverbérations et des zones d'ombre (Vidéos et Figure 26.101). La dimension minimale de l'orifice en systole se situe à l'extrémité des cuspides; il s'agit donc de faire passer le plan de section à ce niveau. La première étape consiste à obtenir une bonne image en long-axe (120-150°) et à centrer l'extrémité des cuspides dans l'axe du faisceau d'ultrason, bien au milieu de l'écran. A partir de là, on procède à une rotation du transducteur jusqu'à 40° pour avoir une vue en court-axe au niveau de l'extrémité des cuspides (Figure 26.102). Lorsque le centrage est correct, le pourtour de la valve apparaît quasi circulaire.
Vidéo: vue long-axe d'une sténose serrée de la valve aortique; les cuspides sont pratiquement immobiles; les calcifications de la racine aortique font des cônes d'ombre.
Vidéo: vue court-axe d'une sténose serrée de la valve aortique; les cuspides droite et non-coronaire sont immobilisées par les dépôts calciques; seule la cuspide gauche permet une faible ouverture en systole.
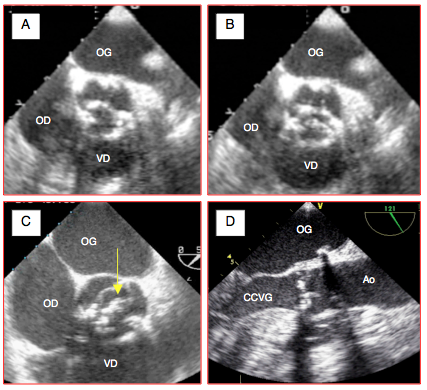
Figure 26.101 : Images ETO de sténose aortique. A: calcification et rigidification d'une valve tricuspide en diastole (A) et en systole (B); les mouvements des cuspides sont très restreints; l'ouverture systolique, en forme d'étoile à 3 branches, est minime. C: sténose sur bicuspide acquise; l'ouverture est en forme de banane (flèche jaune). D: en vue long-axe, la valve se présente comme un mur immobile; les calcifications projettent des cônes d'ombre.
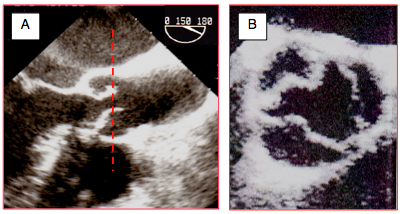
Figure 26.102 : Technique pour l'abtention d'une image co-planaire de la valve aortique en court-axe. A: la première étape consiste à obtenir une bonne image en long-axe (120-150°) et à centrer l'extrémité des cuspides dans l'axe du faisceau d'ultrason, bien au milieu de l'écran (traitillé rouge). B: à partir de là, on procède à une rotation du transducteur jusqu'à 40° pour avoir une vue en court-axe au niveau de l'extrémité des cuspides (sténose modeste dans le cas illustré).
La différentiation étiologique entre dégénérescence calcifiée, bicuspide et RAA devient difficile dans les sténoses très serrées et très calcifiées où l’on ne distingue plus les structures et où l’ouverture est un chenal vaguement triangulaire au sein d’une masse quasi-immobile. La perte de mobilité de la valve en systole et la petitesse de l’orifice, qui est parfois même invisible, permettent cependant de certifier que la sténose est serrée, même si une mesure planimétrique fiable est impossible.
Planimétrie
La planimétrie de l’ouverture systolique en court-axe à 40° est une mesure directe de la sténose indépendante des conditions hémodynamiques. Elle permet de mesurer le degré de sténose aortique (Figure 26.103) [4,11] :

Figure 26.103 : Planimétrie de la surface d’ouverture en cas de sténose aortique serrée en court-axe 40° ; cette mesure est indépendante de l’hémodynamique, mais elle peut être difficile et imprécise lorsque les calcifications sont très importantes. A : planimétrie de la surface d’ouverture en court-axe 40° ; la surface mesurée est 0.86 cm2. B : planimétrie impossible dans cette vue en court-axe 50°; la flèche indique la minuscule ouverture en systole, mais l'imprécision de l'image valvulaire envahie de calcium ne permet pas la quantification. C : vue long-axe d’une valve aortique sténosée et calcifiée ; l’articulation des feuillets sur l’anneau est très difficile à identifier, particulièrement dans la partie antérieure (cercle jaune) qui est dans l’ombre des calcifications postérieures ; la mesure du diamètre de l’anneau est imprécise dans ces conditions. D : schéma illustrant le problème majeur de la planimétrie dans la sténose aortique. La valve sténosée est déformée en cône ; il est impossible de savoir à quel niveau exact de ce cône passe le plan de coupe 2D. Selon le niveau, la surface varie du simple au double. Coupe 1 : plan de coupe correct à l’endroit le plus rétréci. Coupe 2 : plan de coupe surestimant la surface d’ouverture de la valve. FAM : feuillet antérieur de la valve mitrale. Se : septum interventriculaire. CCVG : chambre de chasse du VG.
Toutefois, cette mesure présente des problèmes majeurs qui la rendent très approximative lorsque la valve est remaniée et calcifiée [10,12].
Sténose sous-aortique
Cette malformation congénitale consiste en un anneau fibro-musculaire fixe rétrécissant la chambre de chasse en amont de la valve aortique (Vidéos et Figure 26.104). Elle se manifeste par une clinique de sténose aortique, le plus souvent dans l’enfance ou l’adolescence. La valve aortique elle-même est souvent déformée, hypoplasique et insuffisante à cause du stress imposé par le flux rapide et turbulent qu'elle reçoit. Le flux est accéléré dans la CCVG (aliasing) et des tourbillons (mosaïque de couleurs) apparaissent en amont de la valve au flux Doppler couleur.
Vidéo: vue long-axe de la chambre de chasse du VG avec une membrane sous-aortique sous forme d'un renflement fibreux au niveau du septum musculaire.
Vidéo: le Doppler couleur montre un flux tourbillonnaire systolique en amont de la valve aortique.
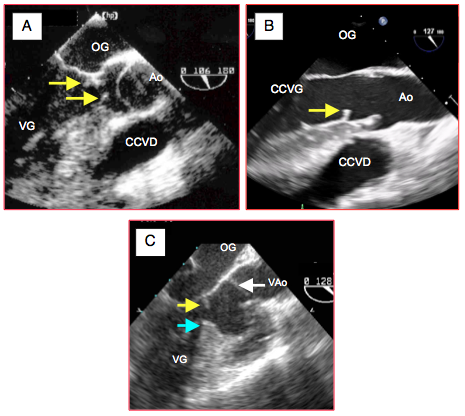
Figure 26.104 : Sténose membranaire sous-aortique. A: une membrane (flèches) circulaire rétrécit la chambre de chasse en amont de la valve aortique ; elle est fixée au septum interventriculaire, au feuillet antérieur de la mitrale et à la paroi postérieure du VG. L'orifice au centre de la membrane correspond à une sténose serrée. La valve aortique est bicuspide, avec un prolapsus dans la chambre de chasse. B: membrane partielle n'obstruant pas la CCVG; la valve aortique est normale. CCVD : chambre de chasse droite. C: sténose mixte membraneuse au niveau mitral (flèche jaune) et musculaire au niveau septal (flèche bleue).
La sténose sous-aortique peut aussi être d'origine musculaire; elle est dite dynamique parce qu'elle s'accentue lors de la contraction systolique. Elle est souvent le fait d'un éperon septal hypertrophié qui bombe dans la chambre de chasse en systole et y provoque une accélération du flux (Figure 26.105).
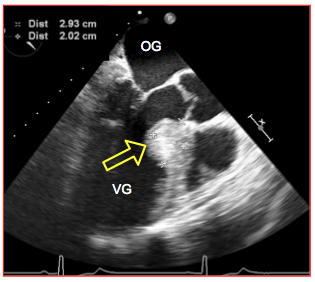
Figure 26.105 : Sténose musculaire sous-aortique. L'éperon septal très proéminent est la cause d'une accélération du flux systolique dans la CCVG, qu'il obstrue partiellement en systole (image en diastole).
Echo 3D
L'imagerie tridimensionnelle de la valve aortique est plus délicate à réaliser que celle de la valve mitrale. Elle permet néanmoins d'avoir une meilleure visualisation des cuspides dans l'espace et de lever l'ambiguïté sur l'identité de la cuspide la plus proximale dans la vue long-axe. En court-axe, elle fournit une vue "en-face" identique à celle du chirurgien qui aborde la valve par la racine de l'aorte (Vidéo et Figure 26.106).
Vidéo: vue 3D "en-face" d'une sténose valvulaire serrée dans un cas de biscuspidie aortique.
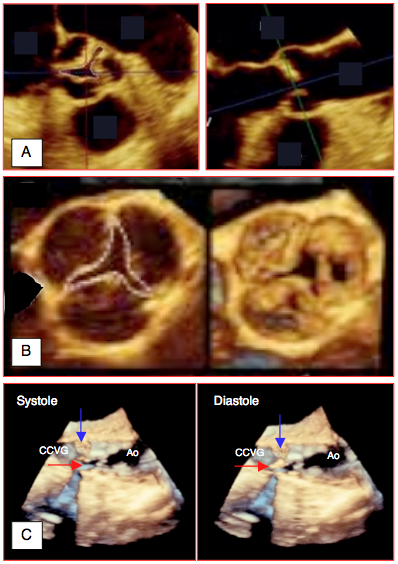
Figure 26.106 : Images tridimensionnelles de sténose aortique, A: vues court-axe et long-axe d'une sténose aortique serrée. B: vue court-axe (vue en-face depuis l'aorte); le 3D permet une planimétrie de l'orifice au niveau de l'extrémité des cuspides, dans une découpe légèrement distale par rapport à leur masse calcifiée. C: vue en long-axe en systole et en diastole. La flèche bleue signale la cuspide non-coronarienne qui est un bloc immobile; la flèche rouge montre la cuspide droite, ouverte en systole et fermée en diastole.
La surface d'ouverture planimétrée en 3D est en général plus petite que celle établie en 2D, car la reconstruction 3D permet de sélectionner le plan de coupe passant par l'extrémité des cuspides, là où le cône formé par la valve rétrécie est le plus étroit (voir Figure 26.103) [7,9]. L'écho 3D montre également que la section de la chambre de chasse du VG (CCVG) n'est pas circulaire mais ovale, et que l'écho 2D coupe le plus petit diamètre de cette structure. Ainsi la surface de la CCVG est sous-estimée de 17% en moyenne, ce qui conduit à une sous-estimation équivalente de la surface aortique calculée au moyen de l'équation de continuité [8]. L'écho 3D corrige cette erreur (voir Figure 25.143)

Figure 25.143 : Exemples d’imagerie 3D de la valve aortique et de la chambre de chasse. A: valve aortique normale en systole dans une vue analogue à la vue court-axe 40°; on voit un cathéter de Swan-Ganz dans l’artère pulmonaire (flèche). B: CCVG en vue 3D dans le plan coronal (court-axe) dans sa portion proximale (jonction VG-CCVG). C: vue identique dans le tiers distal. La section est clairement elliptique, le plus petit diamètre étant vertical; le trait pointillé indique le plan de coupe long axe 120° dans lequel on mesure le diamètre de la CCVG en 2D [Extrait de: Montealegre-Gallegos M, et al. Heterogeneity in the structure of the left ventricular outflow tract: a 3-dimensional transesophageal echocardiographic study. Anesth Analg 2016; 123:290-6]. D: profil du flux systolique dans la CCVG; le flux le plus rapide est au niveau de l'éperon septal [Extrait de: Poh KK. Assessing aortic valve area in aortic stenosis by continuity equation: a novel approach using real-time three-dimensional echocardiography. Eur Heart J 2008; 29:2526-35].
Remodelage du VG
L’augmentation de postcharge induit une hypertrophie concentrique du VG (HVG), dont la paroi s’épaissit (> 1.2 cm en diastole) et la cavité se rétrécit (Vidéo et Figure 26.107). L’absence d’HVG concentrique est le marqueur d’une inadaptation du ventricule, d’une dysfonction gauche ou d’une sténose peu importante.
Vidéo: vue court-axe transgastrique d'une hypertrophie concentrique sévère du VG sur sténose aortique serrée.
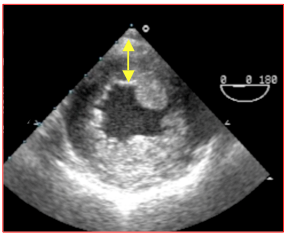
Figure 26.107 : Hypertrophie concentrique du VG dans un cas de sténose aortique serrée. L'épaisseur de la paroi postérieure est de 1.5 cm en diastole. La cavité du VG est très rétrécie.
La fonction systolique est en général conservée, mais l’épaississement du VG s’accompagne d’une dysfonction diastolique (voir Chapitre 25 Fonction diastolique). La dilatation de l’OG (diamètre > 5 cm) est un signe pathognomonique de cette dysfonction diastolique qui, dans les cas bénins, se traduit par un défaut de relaxation.
Lorsque la fonction systolique du VG est altérée, les indices éjectionnels sont inadaptés à l’évaluation de celle-ci à cause de la postcharge excessive et de l’HVG. Il est préférable d’utiliser d’autres critères de dysfonction.
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
La surface d’ouverture de la valve aortique change de forme au cours de la systole (voir Figure 26.72). En protosystole, elle est circulaire pendant un court instant, puis elle prend la forme d’un triangle isocèle pendant plus des deux tiers de la durée d’éjection et se referme en télésystole sous forme d’une étoile de mer à 3 branches [6]. Pour la mesure du volume systolique (VS = S • ITV), il est recommandé d’utiliser la forme triangulaire calculée entre les 3 commissure en court axe 40° (Vidéo) [3].
Vidéo: valve aortique normale en vue court-axe 40°; la valve change de forme au cours de la systole.
| Examen 2D de la valve aortique |
| Vue court-axe 40° : cuspides gauche, droite et non-coronaire, tronc commun, CD Vue long-axe 120° : cuspides droite et non-coronaire (ou partfois gauche), mesures de diamètre Vue 4-5 cavités transgastrique 0° : cuspides droite et gauche, alignement avec le flux aortique Vue long axe transgastrique 120° : cuspides droite et non-coronaire, alignement avec le flux aortique Les mesures de diamètres sont effectuées en mésosystole en vue long-axe mi-œsophage 120°; seule la mesure du diamètre de l'aorte ascendante est effectée en diastole. |
Vues ETO 2D de la sténose aortique
La valve aortique est située dans un plan à 40° par rapport au plan horizontal ; l’axe de l’aorte ascendante est à environ 130°. Une sténose aortique entraîne une hypertrophie concentrique du VG et une ectasie avec déroulement de l’aorte post-sténotique. Ce remodelage modifie l’axe CCVG – racine de l’aorte ; il devient plus horizontal. En se déroulant, l’aorte ascendante empiète sur l’OD et peut apparaître en surplomb de celle-ci en vue 4-cavités (Figure 26.100).
Figure 26.100 : Position spatiale de la valve aortique. Son court-axe est dans un plan à 40° (rouge) par rapport au plan horizontal du thorax [2]. La silhouette rouge indique le déroulement de l’aorte ascendante lors de sténose aortique ; l’aorte empiète sur la partie supérieure de l’OD.
L'image de la sténose aortique est caractéristique: le mouvement des cuspides est restreint par la rigidité, les calcifications ou les fusions commissurales. En vue long-axe, elles sont déformées en dôme ou en crochet; lorsque leur espacement en systole est ≤ 6 mm, la sténose est sévère. En vue court-axe, l'orifice ressemble à une étoile à trois branches. La forte échogénicité du calcium rend la définition des structures souvent difficile à cause des réverbérations et des zones d'ombre (Vidéos et Figure 26.101). La dimension minimale de l'orifice en systole se situe à l'extrémité des cuspides; il s'agit donc de faire passer le plan de section à ce niveau. La première étape consiste à obtenir une bonne image en long-axe (120-150°) et à centrer l'extrémité des cuspides dans l'axe du faisceau d'ultrason, bien au milieu de l'écran. A partir de là, on procède à une rotation du transducteur jusqu'à 40° pour avoir une vue en court-axe au niveau de l'extrémité des cuspides (Figure 26.102). Lorsque le centrage est correct, le pourtour de la valve apparaît quasi circulaire.
Vidéo: vue long-axe d'une sténose serrée de la valve aortique; les cuspides sont pratiquement immobiles; les calcifications de la racine aortique font des cônes d'ombre.
Vidéo: vue court-axe d'une sténose serrée de la valve aortique; les cuspides droite et non-coronaire sont immobilisées par les dépôts calciques; seule la cuspide gauche permet une faible ouverture en systole.
Figure 26.101 : Images ETO de sténose aortique. A: calcification et rigidification d'une valve tricuspide en diastole (A) et en systole (B); les mouvements des cuspides sont très restreints; l'ouverture systolique, en forme d'étoile à 3 branches, est minime. C: sténose sur bicuspide acquise; l'ouverture est en forme de banane (flèche jaune). D: en vue long-axe, la valve se présente comme un mur immobile; les calcifications projettent des cônes d'ombre.
Figure 26.102 : Technique pour l'abtention d'une image co-planaire de la valve aortique en court-axe. A: la première étape consiste à obtenir une bonne image en long-axe (120-150°) et à centrer l'extrémité des cuspides dans l'axe du faisceau d'ultrason, bien au milieu de l'écran (traitillé rouge). B: à partir de là, on procède à une rotation du transducteur jusqu'à 40° pour avoir une vue en court-axe au niveau de l'extrémité des cuspides (sténose modeste dans le cas illustré).
La différentiation étiologique entre dégénérescence calcifiée, bicuspide et RAA devient difficile dans les sténoses très serrées et très calcifiées où l’on ne distingue plus les structures et où l’ouverture est un chenal vaguement triangulaire au sein d’une masse quasi-immobile. La perte de mobilité de la valve en systole et la petitesse de l’orifice, qui est parfois même invisible, permettent cependant de certifier que la sténose est serrée, même si une mesure planimétrique fiable est impossible.
Planimétrie
La planimétrie de l’ouverture systolique en court-axe à 40° est une mesure directe de la sténose indépendante des conditions hémodynamiques. Elle permet de mesurer le degré de sténose aortique (Figure 26.103) [4,11] :
- Surface normale 3.0 – 4.0 cm2
- Sténose mineure 1.5 – 2.0 cm2
- Sténose modérée 1.0 – 1.5 cm2
- Sténose serrée ≤ 1.0 cm2 (≤ 0.6 cm2/m2)
- Vitesse de progression 0.05 – 0.1 cm2/an
Figure 26.103 : Planimétrie de la surface d’ouverture en cas de sténose aortique serrée en court-axe 40° ; cette mesure est indépendante de l’hémodynamique, mais elle peut être difficile et imprécise lorsque les calcifications sont très importantes. A : planimétrie de la surface d’ouverture en court-axe 40° ; la surface mesurée est 0.86 cm2. B : planimétrie impossible dans cette vue en court-axe 50°; la flèche indique la minuscule ouverture en systole, mais l'imprécision de l'image valvulaire envahie de calcium ne permet pas la quantification. C : vue long-axe d’une valve aortique sténosée et calcifiée ; l’articulation des feuillets sur l’anneau est très difficile à identifier, particulièrement dans la partie antérieure (cercle jaune) qui est dans l’ombre des calcifications postérieures ; la mesure du diamètre de l’anneau est imprécise dans ces conditions. D : schéma illustrant le problème majeur de la planimétrie dans la sténose aortique. La valve sténosée est déformée en cône ; il est impossible de savoir à quel niveau exact de ce cône passe le plan de coupe 2D. Selon le niveau, la surface varie du simple au double. Coupe 1 : plan de coupe correct à l’endroit le plus rétréci. Coupe 2 : plan de coupe surestimant la surface d’ouverture de la valve. FAM : feuillet antérieur de la valve mitrale. Se : septum interventriculaire. CCVG : chambre de chasse du VG.
Toutefois, cette mesure présente des problèmes majeurs qui la rendent très approximative lorsque la valve est remaniée et calcifiée [10,12].
- La masse compacte des cuspides très rigides prend la forme d’un cône irrégulier qui plonge dans la racine aortique en systole ; il est difficile de savoir à quel niveau de ce cône passe la coupe en court-axe ; rien ne permet d'être certain que la mesure soit réalisée à l’endroit effectivement le plus rétréci (Figure 26.103D). La reconstruction 3D offre davantage de précision et montre que la planimétrie en 2D tend à surestimer la surface d’ouverture réelle (Vidéos).
- Le plan de la surface d'ouverture n'est pas forcément parallèle au plan de l'anneau aortique ni perpendiculaire au flux; cette angulation introduit une marge d'erreur supplémentaire.
- Les calcifications proximales sur le trajet des ultrasons créent des zones d’ombre et masquent les structures distales ; il devient très difficile de déterminer le bord exact de l’orifice dans sa portion antérieure.
- La valve peut être très déformée, au point que le court-axe échocardiographique n’est pas perpendiculaire à l’axe du chenal tortueux entre les calcifications; il peut être oblique ou coudé ; on ne retrouve aucune surface d’ouverture mesurable en court-axe.
- Le réglage du gain et de la compression modifie la brillance des zones calcifiées et les limites des tissus, conduisant à une sous- ou à une sur-estimatiuon de la surface.
- La planimétrie de la surface anatomique est probablement moins intéressante que la surface effective calculée par les flux Doppler au moyen de l'équation de continuité, car cette dernière est mieux corrélée au devenir des patients que la première.
Vidéo: vue court-axe d'une sténose calcifiée serrée de la valve aortique; seules 2 des 3 branches de l'étoile s'ouvrent un peu en systole autour de la cuspide gauche.
Vidéo: vue 3D long-axe d'une sténose aortique serrée; seule la cuspide droite bouge en systole.
Sténose sous-aortique
Cette malformation congénitale consiste en un anneau fibro-musculaire fixe rétrécissant la chambre de chasse en amont de la valve aortique (Vidéos et Figure 26.104). Elle se manifeste par une clinique de sténose aortique, le plus souvent dans l’enfance ou l’adolescence. La valve aortique elle-même est souvent déformée, hypoplasique et insuffisante à cause du stress imposé par le flux rapide et turbulent qu'elle reçoit. Le flux est accéléré dans la CCVG (aliasing) et des tourbillons (mosaïque de couleurs) apparaissent en amont de la valve au flux Doppler couleur.
Vidéo: vue long-axe de la chambre de chasse du VG avec une membrane sous-aortique sous forme d'un renflement fibreux au niveau du septum musculaire.
Vidéo: le Doppler couleur montre un flux tourbillonnaire systolique en amont de la valve aortique.
Figure 26.104 : Sténose membranaire sous-aortique. A: une membrane (flèches) circulaire rétrécit la chambre de chasse en amont de la valve aortique ; elle est fixée au septum interventriculaire, au feuillet antérieur de la mitrale et à la paroi postérieure du VG. L'orifice au centre de la membrane correspond à une sténose serrée. La valve aortique est bicuspide, avec un prolapsus dans la chambre de chasse. B: membrane partielle n'obstruant pas la CCVG; la valve aortique est normale. CCVD : chambre de chasse droite. C: sténose mixte membraneuse au niveau mitral (flèche jaune) et musculaire au niveau septal (flèche bleue).
La sténose sous-aortique peut aussi être d'origine musculaire; elle est dite dynamique parce qu'elle s'accentue lors de la contraction systolique. Elle est souvent le fait d'un éperon septal hypertrophié qui bombe dans la chambre de chasse en systole et y provoque une accélération du flux (Figure 26.105).
Figure 26.105 : Sténose musculaire sous-aortique. L'éperon septal très proéminent est la cause d'une accélération du flux systolique dans la CCVG, qu'il obstrue partiellement en systole (image en diastole).
Echo 3D
L'imagerie tridimensionnelle de la valve aortique est plus délicate à réaliser que celle de la valve mitrale. Elle permet néanmoins d'avoir une meilleure visualisation des cuspides dans l'espace et de lever l'ambiguïté sur l'identité de la cuspide la plus proximale dans la vue long-axe. En court-axe, elle fournit une vue "en-face" identique à celle du chirurgien qui aborde la valve par la racine de l'aorte (Vidéo et Figure 26.106).
Vidéo: vue 3D "en-face" d'une sténose valvulaire serrée dans un cas de biscuspidie aortique.
Figure 26.106 : Images tridimensionnelles de sténose aortique, A: vues court-axe et long-axe d'une sténose aortique serrée. B: vue court-axe (vue en-face depuis l'aorte); le 3D permet une planimétrie de l'orifice au niveau de l'extrémité des cuspides, dans une découpe légèrement distale par rapport à leur masse calcifiée. C: vue en long-axe en systole et en diastole. La flèche bleue signale la cuspide non-coronarienne qui est un bloc immobile; la flèche rouge montre la cuspide droite, ouverte en systole et fermée en diastole.
La surface d'ouverture planimétrée en 3D est en général plus petite que celle établie en 2D, car la reconstruction 3D permet de sélectionner le plan de coupe passant par l'extrémité des cuspides, là où le cône formé par la valve rétrécie est le plus étroit (voir Figure 26.103) [7,9]. L'écho 3D montre également que la section de la chambre de chasse du VG (CCVG) n'est pas circulaire mais ovale, et que l'écho 2D coupe le plus petit diamètre de cette structure. Ainsi la surface de la CCVG est sous-estimée de 17% en moyenne, ce qui conduit à une sous-estimation équivalente de la surface aortique calculée au moyen de l'équation de continuité [8]. L'écho 3D corrige cette erreur (voir Figure 25.143)
Figure 25.143 : Exemples d’imagerie 3D de la valve aortique et de la chambre de chasse. A: valve aortique normale en systole dans une vue analogue à la vue court-axe 40°; on voit un cathéter de Swan-Ganz dans l’artère pulmonaire (flèche). B: CCVG en vue 3D dans le plan coronal (court-axe) dans sa portion proximale (jonction VG-CCVG). C: vue identique dans le tiers distal. La section est clairement elliptique, le plus petit diamètre étant vertical; le trait pointillé indique le plan de coupe long axe 120° dans lequel on mesure le diamètre de la CCVG en 2D [Extrait de: Montealegre-Gallegos M, et al. Heterogeneity in the structure of the left ventricular outflow tract: a 3-dimensional transesophageal echocardiographic study. Anesth Analg 2016; 123:290-6]. D: profil du flux systolique dans la CCVG; le flux le plus rapide est au niveau de l'éperon septal [Extrait de: Poh KK. Assessing aortic valve area in aortic stenosis by continuity equation: a novel approach using real-time three-dimensional echocardiography. Eur Heart J 2008; 29:2526-35].
Remodelage du VG
L’augmentation de postcharge induit une hypertrophie concentrique du VG (HVG), dont la paroi s’épaissit (> 1.2 cm en diastole) et la cavité se rétrécit (Vidéo et Figure 26.107). L’absence d’HVG concentrique est le marqueur d’une inadaptation du ventricule, d’une dysfonction gauche ou d’une sténose peu importante.
Vidéo: vue court-axe transgastrique d'une hypertrophie concentrique sévère du VG sur sténose aortique serrée.
Figure 26.107 : Hypertrophie concentrique du VG dans un cas de sténose aortique serrée. L'épaisseur de la paroi postérieure est de 1.5 cm en diastole. La cavité du VG est très rétrécie.
La fonction systolique est en général conservée, mais l’épaississement du VG s’accompagne d’une dysfonction diastolique (voir Chapitre 25 Fonction diastolique). La dilatation de l’OG (diamètre > 5 cm) est un signe pathognomonique de cette dysfonction diastolique qui, dans les cas bénins, se traduit par un défaut de relaxation.
- Durée de relaxation isovolumétrique > 100 msec;
- Durée de décélération de l’onde E > 200 msec;
- Propagation du flux mitral < 40 cm/s;
- Rapport E/A < 1.
- Durée de relaxation isovolumétrique < 70 msec;
- Durée de décélération de l’onde E < 150 msec;
- Onde de flux E élevée et pointue;
- Rapport E/E’ > 15;
- Rapport E/A >> 1.
Lorsque la fonction systolique du VG est altérée, les indices éjectionnels sont inadaptés à l’évaluation de celle-ci à cause de la postcharge excessive et de l’HVG. Il est préférable d’utiliser d’autres critères de dysfonction.
- Dilatation télédiastolique: diamètre (Dtd) normal maximal : 6 cm ou 4 cm/m2 ; Std maximale en court-axe : 12 cm2/m2.
- Index de Tei: (tCI + tRI) / téj (somme des durées de la contraction et de la relaxation isovolumétrique divisée par la durée d’éjection). Cet indice est indépendant de la géométrie du VG ; une valeur > 0.4 indique une dysfonction systolique.
- Déformation longitudinale globale (global longitudinal strain): une valeur ≤ 15% au Doppler tissulaire ou au speckle-tracking signe un déficit contractile, même si la fraction d'éjection est encore normale [5].
| Sténose aortique (SA): image bidimensionnelle |
| Caractéristiques bidimensionnelles de la SA sévère: - Faible mobilité des cuspides - Calcifications ou fusion commissurale - Surface d’ouverture planimétrique ≤ 0.6 cm2/m2 (difficulté à mesurer l’orifice minimal) - HVG concentrique (épaisseur paroi postérieure en diastole > 1.2 cm) - Dilatation de l’OG (dysfonction diastolique) Planimétrie de l'ouverture systolique: bien qu'indépendante de l'hémodynamique, cette mesure est difficile et imprécise en écho 2D; elle est plus performante en écho 3D. |
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
- BAUMGARTNER H, HUNG J, BERMEJO J, et al. Recommendations on the echocardiographic assessment of aortic valve stenosis: a focused update from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. Eur Heart J Cardiovasc Imaging 2017; 18:253-75
- BETTEX D, CHASSOT PG. Echocardiographie transoesophagienne en anesthésie-réanimation. Paris, Masson, Williams & Wilkins, 1997
- BETTEX DA, HINSELMANN V, HELLERMANN JP, JENNI R, SCHMID ER. Inaccuracy of cardiac output determination by transoesophageal echocardiography. Anaesthesia 2004; 59:1184-92
- BONOW RO, CARABELLO B, KARU C, et al. ACC/AHA guidelines for the management of patients with valvular heart disease: Executive summary. Circulation 2006; 114:284-91
- DAHL JS, VIDEBAECK L, POULSEN MK, et al. Global strain in severe aortic valve stenosis: Relation to clinical outcome after aortic valve replacement. Circ Cardiovasc Imaging 2012; 5:613-20
- DARMON PL, HILLEL Z, MOGTADER A, et al. Cardiac output by transesophageal echocardiography using continuous-wave Doppler across th aortic valve. Anesthesiology 1994; 80:796-805
- FURUKAWA A, ABE Y, TANAKA C, et al. Comparison of two-dimensional and real-time three-dimensional transesophageal echocardiography in the assessment of aortic valve area. J Cardiol 2012; 59:337-43
- GASPAR T, ADAWI S, SACHNER R, et al. Three-dimensional imaging of the left ventricular outflow tract: impact on aortic valve area estimation by the continuity equation. J Am Soc Echocardiogr 2012; 25:749-57
- HAHN RT, LITTLE SH, MONOGHAN MJ, et al. Recommendations for comprehensive intraprocedural echocardiographic imaging during TAVR. JACC Cardiovasc Imaging 2015; 8:261-87
- HOFFMANN R, FLASCHKAMPF FA, HANRATH P. Planimetry of orifice area in aortic stenosis using multiplane transesophageal echocardiography. J Am Coll Cardiol 1993; 22:529-34
- NISHIMURA RA, CARABELLO BA, FAXON DP, et al. 2008 focused update incorporated into the ACC/AHA 2006 Guidelines for the management of patients with valvular disease. J Am Coll Cardiol 2008; 52:e1-e142
- TARDIF JC, RODRIGUES AG, HARDY JF, et al. Simultaneous determination of aortic valve area by the Gorlin formula and by transesophageal echocardiography under different transvalvular flow conditions. Evidence that anatomic aortic valve area does not change with variations in flow in aortic stenosis. J Am Coll Cardiol 1997; 29:1296-302





























