Step 4 of 5
Quantification de la sténose aortique
Lorsqu’elle est possible, la planimétrie de l’orifice anatomique est une mesure indépendante de l’hémodynamique, mais il est difficile de savoir si elle correspond bien au plan de la surface la plus étroite (voir Figure 26.103). D'autre part, les calcifications et les difficultés à trouver le plan de coupe adéquat empêchent une quantification précise dans de nombreux cas. L’alternative est une mesure des vélocités ; elle permet de calculer les gradients de pression par l’équation de Bernoulli et la surface d’ouverture effective par l’équation de continuité [3,27]. Ces deux données sont fondamentales pour la quantification de la sténose aortique.
Gradient de pression
L’équation de Bernoulli formalise la relation entre la vélocité du flux et le gradient de pression:
ΔP = 4 • (V22 – V12) + accélération locale + perte par viscosité
où V1 est la Vmax proximale à la sténose et V2 la Vmax à travers la sténose. Le facteur d'accélération n'est significatif que pour de longs conduits, et les pertes dues à la viscosité n'existent que pour des hématocrites élevés (≥ 60%). L'équation peut donc être modifiée en abandonnant ces deux composantes. Elle spécifie que le gradient de pression maximal (ΔP) est égal à 4 fois la différence entre le carré de la vélocité maximale dans la sténose (VAo) et le carré de la vélocité maximale d’amont (VCCVG, chambre de chasse) :
ΔP = 4 • (V2VAo - V2CCVG)
Il est capital d'inclure dans le calcul la vélocité dans la chambre de chasse dès qu’elle est supérieure à 1.5 m/s (ΔP = 9 mmHg), ce qui est fréquemment le cas lors de surcharge de volume (IA associée), de haut débit cardiaque (stimulation sympathique, shunt, fistule) ou après remplacement de la valve aortique. Il en est de même si la Vmax à travers la valve est < 3 m/s. Ne pas soustraire la VCCVG conduit à surestimer grossièrement le rétrécissement de la valve. Mais lorsque la vélocité proximale est < 1 m/s et la Vmax dans la valve > 3 m/s, l'équation peut être simplifiée en ignorant la vélocité proximale; elle devient alors: ΔP = 4 • (Vmax)2.
La vélocité (Vmax) normale à travers la valve aortique est de 1.0 - 1.5 m/s; le gradient physiologique est inférieur à 7 mmHg. Le gradient est une notion dynamique qui dépend de la pression motrice et du volume systolique. Il varie avec le carré de la vélocité (équation de Bernoulli) ou du débit cardiaque (formule de Gorlin). Lors de sténose, il est augmenté non seulement par l'élévation de la pression intraventriculaire (hyperdynamisme du VG), mais encore par l’augmentation du volume systolique (insuffisance aortique associée, transfusions, shunt) et par la baisse de la pression en aval. Celle-ci peut provenir d’une baisse des résistances systémiques (vasoplégie, choc septique) ou d’une baisse de pression dans l’aorte ascendante due à un anévrysme ou à une contre-pulsion intra-aortique (CPIA); dans ce dernier cas, il faut momentanément interrompre la CPIA pour faire la mesure du gradient aortique, sans quoi on le surestime de ≥ 35 mmHg. En cas d'arythmie, il est important de moyenner la Vmax de 3-5 cycles cardiaques dont la durée de diastole correspond à une fréquence de 60-70 batt/min, de manière à ce que le volume systolique soit approximativement normal. Chez les patients sous ventilation mécanique, la mesure doit se faire pendant la pause télé-expiratoire ou en apnée.
Le gradient maximal a lieu pendant le pic de vélocité au niveau de la vena contracta. Le gradient de pression moyen est calculé par le processeur à partir de l’enveloppe du flux dessinée à l’écran; c'est la moyenne de tous les gradients de pression instantanés enregistrés sur la période du flux. Une sténose serrée est définie par un gradient de pression maximal ≥ 80 mmHg et par un gradient moyen ≥ 40 mmHg. Le ΔPmoy est déterminé par le volume systolique et le ΔPmax par la vélocité du flux (pressions d’amont et d’aval); le premier est moins dépendant des conditions hémodynamiques que le second [5]. Le gradient augmente linéairement avec le rétrécissement aortique.
Gradient de pression
L’équation de Bernoulli formalise la relation entre la vélocité du flux et le gradient de pression:
ΔP = 4 • (V22 – V12) + accélération locale + perte par viscosité
où V1 est la Vmax proximale à la sténose et V2 la Vmax à travers la sténose. Le facteur d'accélération n'est significatif que pour de longs conduits, et les pertes dues à la viscosité n'existent que pour des hématocrites élevés (≥ 60%). L'équation peut donc être modifiée en abandonnant ces deux composantes. Elle spécifie que le gradient de pression maximal (ΔP) est égal à 4 fois la différence entre le carré de la vélocité maximale dans la sténose (VAo) et le carré de la vélocité maximale d’amont (VCCVG, chambre de chasse) :
ΔP = 4 • (V2VAo - V2CCVG)
Il est capital d'inclure dans le calcul la vélocité dans la chambre de chasse dès qu’elle est supérieure à 1.5 m/s (ΔP = 9 mmHg), ce qui est fréquemment le cas lors de surcharge de volume (IA associée), de haut débit cardiaque (stimulation sympathique, shunt, fistule) ou après remplacement de la valve aortique. Il en est de même si la Vmax à travers la valve est < 3 m/s. Ne pas soustraire la VCCVG conduit à surestimer grossièrement le rétrécissement de la valve. Mais lorsque la vélocité proximale est < 1 m/s et la Vmax dans la valve > 3 m/s, l'équation peut être simplifiée en ignorant la vélocité proximale; elle devient alors: ΔP = 4 • (Vmax)2.
La vélocité (Vmax) normale à travers la valve aortique est de 1.0 - 1.5 m/s; le gradient physiologique est inférieur à 7 mmHg. Le gradient est une notion dynamique qui dépend de la pression motrice et du volume systolique. Il varie avec le carré de la vélocité (équation de Bernoulli) ou du débit cardiaque (formule de Gorlin). Lors de sténose, il est augmenté non seulement par l'élévation de la pression intraventriculaire (hyperdynamisme du VG), mais encore par l’augmentation du volume systolique (insuffisance aortique associée, transfusions, shunt) et par la baisse de la pression en aval. Celle-ci peut provenir d’une baisse des résistances systémiques (vasoplégie, choc septique) ou d’une baisse de pression dans l’aorte ascendante due à un anévrysme ou à une contre-pulsion intra-aortique (CPIA); dans ce dernier cas, il faut momentanément interrompre la CPIA pour faire la mesure du gradient aortique, sans quoi on le surestime de ≥ 35 mmHg. En cas d'arythmie, il est important de moyenner la Vmax de 3-5 cycles cardiaques dont la durée de diastole correspond à une fréquence de 60-70 batt/min, de manière à ce que le volume systolique soit approximativement normal. Chez les patients sous ventilation mécanique, la mesure doit se faire pendant la pause télé-expiratoire ou en apnée.
Le gradient maximal a lieu pendant le pic de vélocité au niveau de la vena contracta. Le gradient de pression moyen est calculé par le processeur à partir de l’enveloppe du flux dessinée à l’écran; c'est la moyenne de tous les gradients de pression instantanés enregistrés sur la période du flux. Une sténose serrée est définie par un gradient de pression maximal ≥ 80 mmHg et par un gradient moyen ≥ 40 mmHg. Le ΔPmoy est déterminé par le volume systolique et le ΔPmax par la vélocité du flux (pressions d’amont et d’aval); le premier est moins dépendant des conditions hémodynamiques que le second [5]. Le gradient augmente linéairement avec le rétrécissement aortique.
- Sténose mineure : surface 1.5 cm2, ΔPmoy < 25 mmHg, Vmax < 3 m/s.
- Sténose modérée : surface 1.0-1.5 cm2, ΔPmoy 25-40 mmHg, Vmax 3-4 m/s.
- Sténose sévère : surface < 1.0 cm2, ΔPmoy > 40 mmHg, Vmax > 4 m/s.
La lecture des rapports de cardiologie montre souvent des disparités dans les gradients calculés; il existe en effet trois gradients différents (Figure 26.113).
- Gradient pic-à-pic (cathétérisme): différence entre les pressions maximales ventriculaire et aortique. Ces deux pressions ne sont pas simultanées; ce gradient n’existe pas réellement dans la nature.
- Gradient maximal (écho): différence de pression calculée lors de la plus grande vélocité transvalvulaire, qui a lieu pendant l’accélération du flux en début de systole (gradient instantané maximal).
- Gradient moyen (écho): moyenne de la somme des gradients instantanés; le gradient moyen est une meilleure estimation du degré d’obstruction, parce qu’il est moins dépendant des conditions hémodynamiques et moins sujet à une surestimation de la sténose. Il est identique lorsqu’on le mesure par échocardiographie ou par cathétérisme.
Figure 26.113 : Les trois types de gradient dans le cas d’une sténose aortique. Le gradient maximal (ΔPmax) (1) mesuré à l’échocardiographie correspond à la vélocité maximale du flux (courbe de flux verte et flèche verte). Le gradient pic-à-pic (flèche bleue) (2) est une mesure de cathétérisme qui ne correspond pas à des valeurs simultanées et qui est toujours inférieur au ΔPmax ; la différence entre les deux est d’autant plus grande que la sténose est plus modeste. Le gradient moyen (ΔPmoy) (3) est la moyenne de tous les gradients instantanés.
Les gradients sont directement proportionnels à la fonction systolique du VG, mais les indices éjectionnels comme la fraction d'éjection sont mal adaptés à l’évaluation de celle-ci à cause de la postcharge excessive et de l’HVG concentrique. Il est préférable d’utiliser d’autres critères de dysfonction ventriculaire.
- Dilatation télédiastolique du VG: diamètre > 6 cm ou > 4 cm/m2 ; surface (court-axe) > 12 cm2/m2.
- Indice de performance myocardique > 0.4 (indice de Tei: somme des durées de la contraction et de la relaxation isovolumétrique divisée par la durée d’éjection); cet indice est indépendant de la géométrie du VG.
- Raccourcissement tissulaire longitudinal en systole (global longitudinal strain) < 15% [14].
Calcul de la surface par l'équation de continuité
L’équation de continuité spécifie que le flux est identique tout au long d’un parcours puisque les liquides sont incompressibles. Le flux est le produit de la surface et de la Vmax, alors que le volume propulsé est le produit de la surface et de l’intégrale des vélocités (ITV):
Flux (mL/s) S (cm2) • Vmax (cm/s)
Volume systolique (mL) S (cm2) • ITV (cm)
Comme le flux à travers la CCVG est le même que le flux à travers la valve, on peut calculer la surface de la valve aortique (SVAo) si l'on connaît la surface de la CCVG, la vélocité de la CCVG et la vélocité à travers la sténose aortique (Figure 26.114).
S1 • V1 = S2 • V2
S2 = (S1 • V2) / V2 ou SVAo = (SCCVG • VmaxCCVG) / VmaxVAo
SVAo = (SCCVG • ITVCCVG) / ITVVAo
L'utilisation de l'intégrale des vélocités est préférable, car elle représente l'ensemble des vélocités par rapport au temps (durée de l'éjection systolique). La surface de la CCVG se calcule en mesurant son diamètre (D) en vue long axe mi-oesophage 120° 3-5 mm en amont de la valve au moyen de la formule : S = D2 • 0.785. Le diamètre de la CCVG est en moyenne 2.0 cm chez la femme et 2.2 cm chez l’homme (1.8 – 2.4 cm).
Figure 26.114 : L’équation de continuité exprime la loi de conservation de masse : le produit de la vélocité du flux (trait rouge) et de la surface du tube est constant. Dans la zone rétrécie, la vélocité augmente, mais la pression baisse (trait jaune dans le schéma supérieur, trait vert dans le schéma inférieur); c’est le principe de la conservation de l’énergie cinétique. La pression remonte dans la zone distale au rétrécissement (Pr: pressure recovery), avec une perte de charge due aux frottements et aux tourbillons (P’ < P). L’échocardiographie mesure le gradient de pression à partir de la vélocité maximale : ΔP = 4 (V22 – V12), donc au niveau de la vena contracta et avant la récupération de pression [34].
Hormis les pertes dues à la friction et aux tourbillons post-sténotiques, le produit de l'énergie cinétique (Ec) et de l'énergie de pression (Ep) reste constant. Au passage d'une sténose, la vitesse s'accélère (hausse de Ec) et la pression diminue (baisse de Ep); c'est la situation juste à la sortie de la sténose, au niveau de la vena contacta. Au-delà de la sténose, la chambre de réception est plus large, la vitesse diminue et la pression réaugmente: c'est le phénomène de la récupération de pression (pressure recovery) ou reconversion de Ec en Ep distalement à la vena contracta. Cette transformation peut représenter une diminution de 20% du gradient de pression réel à travers une sténose aortique lorsque le diamètre de l'aorte est faible (< 3 cm) ou lorsque la sténose s'élargit progressivement, ce qui réduit l'importance des turbulences [4]. Lorsque le phénomène de récupération de pression est important comme dans les prothèses valvulaires à double ailette, l'écho surestime le gradient de pression et calcule une surface aortique inférieure à la réalité [3].
L'équation de continuité implique trois techniques différentes d'échocardiographie.
- Mesure bidimensionnelle du diamètre de la CCVG en vue long-axe 120-140° mi-œsophage;
- Mesure la Vmax de la CCVG au Doppler pulsé en vue transgastrique 0° ou 120°;
- Mesure de la Vmax à travers la valve aortique au Doppler continu en vue transgastrique 0° ou 120°.
La surface mesurée par l'équation de continuité est la surface effective de la valve, non sa surface anatomique. A cause de la contraction du flux au niveau de la vena contracta où la vélocité est maximale, elle est plus petite d'environ 15% par rapport à l'ouverture située entre les cuspides. Le degré d'excentricité du jet systolique modifie également la dimension de la vena contracta: un jet très excentrique diminue sa section de 15% supplémentaire [11]. Néanmoins, la surface effective représente l'obstacle réel à l'éjection du VG, preuve en est sa meilleure corrélation au devenir des patients que la surface anatomique [3].
La recherche de la surface aortique est une opération fréquente en échocardiographie. Elle comporte certaines particularités (Figure 56.115).
La recherche de la surface aortique est une opération fréquente en échocardiographie. Elle comporte certaines particularités (Figure 56.115).
- SCCVG: surface de la CCVG calculée par son diamètre mésosystolique mesuré en vue long axe rétrocardiaque à 120° (en moyenne 1.9-2.2 cm): S = π • r2 = 0.785 • D2. Ceci présuppose que la surface est circulaire. Or la section de la CCVG est ovale, et la vue échocardiographique mesure le petit diamètre de cet ovale, ce qui entraine une sous-estimation de 17% du diamètre réel; cette erreur est ensuite portée au carré dans le calcul de la surface (24% de différence) [12,28]. Cette erreur se traduit par une sous-estimation de la surface aortique. D'autre part, il arrive qu'une coulée calcique venue de la valve aortique envahisse le feuillet mitral antérieur; cette masse rétrécit le diamètre mesuré mais ne fait pas le tour de la CCVG. Dans ce cas, la surface de la CCVG est également sous-estimée. La mesure du diamètre de la chambre de chasse est ainsi la principale source d'erreur dans l'équation de continuité [3].
- VCCVG: vélocité maximale ou ITV de la CCVG mesuré au Doppler pulsé en vue long axe transgastrique à 0° ou 120° ; la fenêtre est positionnée 5 mm en amont de la valve aortique, au milieu du flux, en évitant de la placer dans la zone d'accélération pré-sténotique. Pour ce faire, on place le volume d'échantillonnage d'abord sous la valve, où l'image spectrale présente un large spectre de vélocités assez élevées; on le recule ensuite lentement en direction du VG jusqu'à ce qu'on obtienne une courbe à l'enveloppe fine et à la Vmax stable (0.8-1.2 m/s). La présence de son clic de fermeture indique une trop grande proximité avec la valve aortique (Figure 26.116). Les endroits de mesure de la Vmax et du diamètre doivent être situés strictement au même niveau de la CCVG; il en est de même du moment de la mesure, qui doit être mésosystolique pour les deux données.
- VAo: vélocité maximale ou ITV à travers la valve aortique mesurée au Doppler continu en vue long axe transgastrique à 0° ou 120°. Alors que l'écho transthoracique (ETT) peut enregistrer la Vmax de la vena contracta en aval de la valve depuis le creux sus-sternal, l'ETO ne peut se positionner dans l'axe du flux aortique qu'en position transgastrique, soit en amont de la valve. L'axe Doppler doit donc traverser la sténose pour enregistrer la vena contracta, ce qui peut s'avérer très difficile lorsque la valve est sténosée, calcifiée et très remaniée (voir Figure 26.109). En général, la Vmax est sous-estimée par l'ETO.
- Comme les défauts d'axe Doppler sont approximativement les mêmes dans la CCVG et dans la sténose aortique, le rapport VCCVG / VAo présente l'intérêt d'éliminer cette source d'erreur. Normalement, ce rapport est ≥ 0.8. Lorsque la sténose aortique est serrée, il est ≤ 0.25, ce qui signifie que la Vmax à travers la valve est au moins 4 fois supérieure à celle dans la CCVG. Enregistrant toutes les vélocités dans l'axe des ultrasons, le Doppler continu affiche simultanément la Vmax à travers la valve et la Vmax à travers la chambre de chasse (technique dite de la "double enveloppe"). La mesure se fait au cours du même cycle cardiaque, alors que les mesures au Doppler pulsé dans la CCVG et au Doppler continu dans la valve ne peuvent pas être simultanées. Toutefois, il est possible que la VCCVG mesurée de cette manière soit contaminée par la zone d'accélération présténotique et soit de ce fait artificiellement élevée [3,13].
Figure 26.115 : Application de l’équation de continuité au calcul de la surface d'une sténose aortique serrée. A: mesure du diamètre de la chambre de chasse en vue long-axe 120° (flèche rouge). B: alignement du faisceau Doppler continu avec le flux aortique en vue transgastrique profonde 0°; la flèche verte pointe la valve aortique, et la flèche rouge le niveau où placer le volume d'échantillonnage du Doppler pulsé pour obtenir la Vmax de la CCVG. C: enregistrement du flux Doppler continu selon la technique de la double enveloppe (affichage simultané de la Vmax à travers la valve aortique et à travers la CCVG sur la courbe du flux). La Vmax à travers la valve aortique est de 5 m/s (flèche jaune); la Vmax à travers la CCVG est de 0.8 m/s (flèche rouge); le diamètre de la CCVG est 2 cm. La surface de la valve aortique (S = (SCCVG•VCCVG)/VAo) est: (0.785 • 4 cm2 • 0.8 m/s) / 5 m/s = 0.5 cm2.
Figure 26.116 : Clic de fermeture de la valve aortique enregistré au flux Doppler continu transgastrique (flèche jaune); lorsqu'il apparaît sur un enregistrement au Doppler pulsé, la fenêtre de lecture est trop proche de la valve. La flèche bleue indique la limite supérieure de la trace dense, où se lit la Vmax. Le double contour légèrement supérieur (flèche rouge) est considéré comme un artéfact.
Sténose serrée à faible gradient de pression
Il arrive qu’une sténose aortique ait toutes les apparences d’une sténose serrée mais qu’elle ne génère que de modestes gradients de pression. Si elle n’est pas simplement due à un mauvais alignement de l’axe Doppler, l’origine de cette discordance tient en général à une dysfonction ventriculaire. Le rapport de vélocité CCVG / VAo est ici très utile.
- Sténose aortique serrée et fonction ventriculaire normale : le rapport VmaxCCVG / VmaxVAo est 0.2 (1.0 m s-1 / 5.0 m s-1) (définition de la sténose serrée : rapport ≤ 0.25) ;
- Sténose aortique serrée et dysfonction ventriculaire (FE 0.3) : le rapport VCCVG / VVAo reste 0.2 car les deux vélocités ont baissé de la même manière à cause de la dysfonction du VG (0.6 m s-1 / 3 m s-1). Le rapport des vélocités permet de corriger l’effet de la fonction sur la valeur absolue de la vélocité.
Une défaillance ventriculaire (FE < 0.50) peut abaisser le gradient moyen à < 30 mmHg alors que la surface valvulaire est inférieure à 1.0 cm2 (low flow - low gradient). Mais il se peut aussi que la faible éjection ventriculaire ne puisse pas ouvrir correctement une valve aortique simplement sclérosée, ce qui donne l’impression que l’ouverture est plus faible qu’elle ne l’est en réalité (pseudo-sténose). Un écho de stress à la dobutamine (dosage < 10 mcg/kg/min) permet de différencier ces deux situations [3,8,20,25,27].
- Lors de sténose aortique serrée, la Vmax et le gradient de pression augmentent sous dobutamine (≥ 4 m/s et > 30-40 mmHg, respectivement), mais non la surface valvulaire qui reste fixe à cause des calcifications.
- En cas de cardiomyopathie, au contraire, la surface valvulaire mesurée augmente parce que l’amélioration fonctionnelle du VG permet d’augmenter le volume systolique et d’ouvrir davantage la valve, mais le gradient ne se modifie pas [18,25,29].
Sous dobutamine, le rapport entre la vélocité dans la CCVG (ITVCCVG) et la vélocité à travers la valve aortique (ITVVAo) se creuse encore dans la sténose serrée, parce que la VTIVAo augmente davantage que la VTICCVG. En cas de cardiomyopathie et de sténose fonctionnelle, au contraire, le rapport augmente parce que l’accélération est bien plus importante dans la CCVG qu’à travers la valve ; en effet, cette dernière augmente son ouverture et s’adapte à l’accroissement du volume systolique sans modifier son gradient (Figure 26.117) [8].
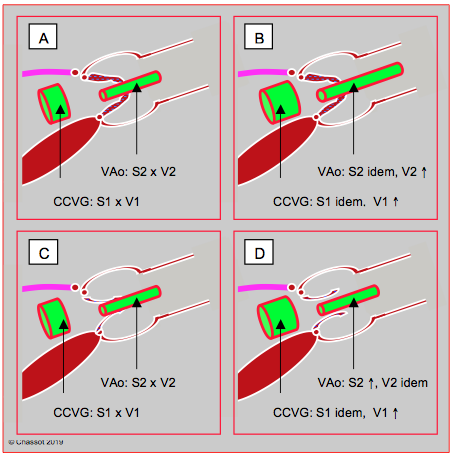
Figure 26.117 : Echo de stress à la dobutamine pour différencier une sténose aortique fixe (en-haut) d’une sténose fonctionnelle (en-bas) en cas de dysfonction ventriculaire et de faible gradient. A : le gradient transvalvulaire est bas malgré une sténose serrée très calcifiée en planimétrie. B : lors de sténose aortique serrée, le gradient de pression augmente de > 20 mmHg sous dobutamine, mais non la surface valvulaire qui reste fixe à cause des calcifications. C : le gradient transvalvulaire est bas malgré une sténose serrée en planimétrie, mais la valve est simplement sclérosée et le VG incapable de l’ouvrir correctement. D : en cas de cardiomyopathie, la surface valvulaire mesurée augmente parce que l’amélioration fonctionnelle du VG permet d’augmenter le volume systolique et d’ouvrir davantage la valve ; la Vmax ne se modifie pas. Dans les deux cas, la surface de la CCVG ne se modifie pas, mais sa vélocité augmente. CCVG : chambre de chasse du VG.
Le test à la dobutamine est diagnostique pour autant que le patient manifeste une réserve contractile et élève son volume systolique de ≥ 20%; dans le cas contraire, aucune conclusion ne peut être tirée [6,25,32]. Une augmentation de pression de < 20 mmHg et de volume éjecté de < 20% sont de mauvais pronostic [2]. Cette réponse inotrope insuffisante stigmatise une défaillance ventriculaire irréversible qui élève à 20-30% la mortalité d’une intervention chirurgicale [17,31]. L’écho de stress est également utile pour démasquer les symptômes chez les porteurs de sténose serrée qui sont asymptomatiques ou qui se dissimulent la réalité en restreignant leur activité. Par contre, il est contre-indiqué chez les malades symptomatiques à gradient élevé [32].
On peut rencontrer parfois une situation paradoxale de bas gradient (ΔPmoy < 40 mmHg) et de sténose serrée (S < 1.0 cm2) en présence d'une fonction ventriculaire normale (FE > 50%). Il s'agit en général de personnes âgées souffrant d'hypertension artérielle sévère et d'hypertrophie concentrique, dont la cavité ventriculaire est particulièrement restrictive et le volume systolique < 35 mL/m2 [27]. Mais des investigations plus fines comme la mesure du raccourcissement longitudinal du VG (strain et strain rate) montrent en fait une dégradation de la fonction contractile et une fibrose avancée [1,15].
Une réponse positive à l'épreuve de stress est une bonne indication opératoire, car la levée de l'obstacle va améliorer la performance du VG; une augmentation du volume systolique de > 20% suggère une réserve contractile favorable à l'intervention [3]. Dans le cas de la pseudosténose, il est probable que le gain d'un remplacement valvulaire aortique (RVA) soit négligeable par rapport au risque, bien que quelques patients puissent être améliorés [10]. En présence d'une certaine réserve contractile, la mortalité postopératoire à une année est < 15%, alors qu'elle est plus du double dans la pseudosténose [19]. La situation à haut risque du patient avec peu de réserve fonctionnelle est une indication à une technique peu invasive comme le TAVI (transcatheter aortic valve implantation, implantation de bioprothèse par cathétérisme percutané).
Sténose aortique sévère
Les critères échocardiographiques d’une sténose aortique sévère sont les suivants (Tableau 26.7) [3,27]:
Figure 26.117 : Echo de stress à la dobutamine pour différencier une sténose aortique fixe (en-haut) d’une sténose fonctionnelle (en-bas) en cas de dysfonction ventriculaire et de faible gradient. A : le gradient transvalvulaire est bas malgré une sténose serrée très calcifiée en planimétrie. B : lors de sténose aortique serrée, le gradient de pression augmente de > 20 mmHg sous dobutamine, mais non la surface valvulaire qui reste fixe à cause des calcifications. C : le gradient transvalvulaire est bas malgré une sténose serrée en planimétrie, mais la valve est simplement sclérosée et le VG incapable de l’ouvrir correctement. D : en cas de cardiomyopathie, la surface valvulaire mesurée augmente parce que l’amélioration fonctionnelle du VG permet d’augmenter le volume systolique et d’ouvrir davantage la valve ; la Vmax ne se modifie pas. Dans les deux cas, la surface de la CCVG ne se modifie pas, mais sa vélocité augmente. CCVG : chambre de chasse du VG.
Le test à la dobutamine est diagnostique pour autant que le patient manifeste une réserve contractile et élève son volume systolique de ≥ 20%; dans le cas contraire, aucune conclusion ne peut être tirée [6,25,32]. Une augmentation de pression de < 20 mmHg et de volume éjecté de < 20% sont de mauvais pronostic [2]. Cette réponse inotrope insuffisante stigmatise une défaillance ventriculaire irréversible qui élève à 20-30% la mortalité d’une intervention chirurgicale [17,31]. L’écho de stress est également utile pour démasquer les symptômes chez les porteurs de sténose serrée qui sont asymptomatiques ou qui se dissimulent la réalité en restreignant leur activité. Par contre, il est contre-indiqué chez les malades symptomatiques à gradient élevé [32].
On peut rencontrer parfois une situation paradoxale de bas gradient (ΔPmoy < 40 mmHg) et de sténose serrée (S < 1.0 cm2) en présence d'une fonction ventriculaire normale (FE > 50%). Il s'agit en général de personnes âgées souffrant d'hypertension artérielle sévère et d'hypertrophie concentrique, dont la cavité ventriculaire est particulièrement restrictive et le volume systolique < 35 mL/m2 [27]. Mais des investigations plus fines comme la mesure du raccourcissement longitudinal du VG (strain et strain rate) montrent en fait une dégradation de la fonction contractile et une fibrose avancée [1,15].
Une réponse positive à l'épreuve de stress est une bonne indication opératoire, car la levée de l'obstacle va améliorer la performance du VG; une augmentation du volume systolique de > 20% suggère une réserve contractile favorable à l'intervention [3]. Dans le cas de la pseudosténose, il est probable que le gain d'un remplacement valvulaire aortique (RVA) soit négligeable par rapport au risque, bien que quelques patients puissent être améliorés [10]. En présence d'une certaine réserve contractile, la mortalité postopératoire à une année est < 15%, alors qu'elle est plus du double dans la pseudosténose [19]. La situation à haut risque du patient avec peu de réserve fonctionnelle est une indication à une technique peu invasive comme le TAVI (transcatheter aortic valve implantation, implantation de bioprothèse par cathétérisme percutané).
Sténose aortique sévère
Les critères échocardiographiques d’une sténose aortique sévère sont les suivants (Tableau 26.7) [3,27]:
- Faible ouverture de la valve aortique en vue 2D court-axe (40°) et long-axe (120°);
- Hypertrophie concentrique du VG et dysfonction diastolique;
- Dilatation de l’OG;
- Vmax aortique : > 4.0 m/s;
- ITV aortique : > 100 cm;
- Gradient moyen : > 40 mmHg;
- Rapport VCCVG / VVAo : ≤ 0.25;
- Rapport durée accélération / durée éjection > 0.4;
- Surface d’ouverture de la valve : ≤ 0.6 cm2/m2.
De fait, un seul des trois critères principaux (S < 1.0 cm2, Vmax > 4.0 m/s, ΔPmoy > 40 mmHg) suffit à suggérer que la sténose est sévère. Toutefois, une surface < 1.0 cm2 manque de spécificité lorsque la Vmax est < 4 m/s et le ΔPmoy < 40 mmHg. Il faut alors préciser les autres conditions, telles un flux normal ou un bas débit, une fonction du VG normale ou abaissée, un score de calcification bas ou élevé.
La marche à suivre face à une image échocardiographique de sténose aortique apparemment serrée commence par la détermination de la vélocité maximale du flux systolique (Vmax) et du gradient de pression moyen (ΔPmoy). S'ils sont respectivement > 4 m/s et > 40 mmHg lorsque le débit systolique est normal, il s'agit d'une sténose serrée. Si le volume systolique est élevé, la mesure est refaite lorsqu'il est normalisé. Toutefois, le haut débit peut être non-réversible (hyperthyroïdisme, IA associée, shunt artério-veineux); dans ce cas, il représente pour le VG une surcharge de pression correspondant à une sténose sévère, et doit être traité comme tel. La plupart du temps, le haut débit se reconnaît à l'élévation de la Vmax dans la chambre de chasse (> 1.2 m/s).
Si la Vmax est < 4 m/s et le gradient moyen < 40 mmHg, il faut rechercher d'abord de possibles erreurs de mesure. La planimétrie, de préférence tri-dimensionnelle, peut confirmer le degré de sténose. Dans la situation d'une surface d'ouverture > 1 cm2, la sténose est certainement modérée si le volume systolique et la fonction ventriculaire sont normaux. Dans la situation d'une sténose serrée (< 1 cm2) avec bas débit, il faut rechercher une dysfonction ventriculaire; lorsque la fraction d'éjection (FE) est < 0.5, on procède à un écho de stress sous dobutamine, qui fait le diagnostic entre sténose réelle et pseudo-sténose. Dans les cas plus rares où la FE est > 0.5, des investigations complémentaires sont recommandées (écho 3D, IRM, CT-scan, cathétérisme); parmi les investigations les plus utiles figure le score de calcium déterminé au CT-scan; un score calcique élevé parle pour une sténose majeure et incite à une thérapeutique chirurgicale comme le TAVI même si le gradient moyen est < 40 mmHg (Figure 26.118) [7].
Figure 26.118 : Algorithme de l'examen échocardiographique en cas de sténose aortique. Etant plus précise qu'en 2D, la planimétrie est préférable en 3D si elle est réalisable. *: un flux systolique élevé est une cause d'augmentation du gradient; sa normalisation permet de déterminer si le gradient reste élevé (sténose sévère) ou s'il s'abaisse (sténose modérée). S'il n'est pas réversible, le haut débit représente pour le VG une surcharge de pression correspondant à une sténose sévère. **: parmi les investigations les plus utiles figure le score de calcium déterminé au CT-scan. Traitillé: les cas de sténose morphologiquement serrée combinée à un gradient bas et une fonction normale du VG correspondent le plus souvent à une sténose effective modérée [3]. Vmax: vélocité maximale. ΔPmoy: gradient de pression moyen. FE: fraction d'éjection.
Discordances
Malgré toutes ces précisions, des inconsistances entre le gradient, la vélocité et la surface surviennent dans environ 30% des cas de sténose aortique serrée [24]. A l'examen ETO pré-CEC, elles se produisent dans 51% des cas. Les discordances sont particulièrement prononcées lorsque le gradient de pression moyen est < 40 mmHg, alors qu'elles sont mineures lorsqu'il est > 40 mmHg (Tableau 26.8) [33]. Comment procéder lorsque l'échocardiographeur est confronté à ce problème [3] ?
- Vérifier s'il ne s'agit pas de simples erreurs de mesure: mauvais alignement de l'axe du Doppler, erreur de mesure sur le diamètre de la CCVG. Chez les adolescents et chez les personnes de petite taille, la valve aortique est de plus faible dimension; il est donc recommandé d'indexer la surface de la valve à la surface corporelle.
- S'assurer d'une bonne stabilité hémodynamique au cours de l'examen. La variation du volume systolique (VS) modifie la vélocité et le gradient à travers la valve aortique (voir Tableau 26.8).
- Flux élevé (augmentation du gradient): stimulation sympathique, anémie, fièvre, shunt artério-veineux (dialyse), vasodilatation, CPIA; dans ces circonstances, la Vmax dans la CCVG est excessive (> 1.2 m/s).
- Flux abaissé (diminution du gradient): hypovolémie, hypertension artérielle, dépression myocardique (anesthésie).
- Mesurer le volume systolique à l'ETO (VS = SCCVG • ITVCCVG) ou par une technique de monitorage (PiCCO, Swan-Ganz, etc); une HVG concentrique majeure peut réduire le VS à < 35mL/m2.
- Rechercher les pathologies associées: insuffisance aortique (VS élevé), insuffisance mitrale (transfert d'une partie du VS vers la mitrale et l'OG), sténose mitrale (VS faible), hypertension artérielle sévère (diminution du gradient). Au Doppler, on peut confondre le jet d'une IM sévère avec celui d'une sténose aortique, bien que leur morphologie soit différente (voir Figure 26.112).
- Tenir compte des erreurs liées aux méthodes de mesure utilisées [26].
- La section de la chambre de chasse n'est pas circulaire mais elliptique; l'ETO mesurant le plus petit diamètre, l'équation de continuité sous-estime la surface aortique de 15-20%.
- La planimétrie bi-dimensionnelle tend à surestimer la surface de la valve, car le plan de coupe a peu de chance de passer exactement par le niveau le plus rétréci du cône.
- L'équation de continuité mesure la surface hémodynamiquement effective (vena contracta), qui est inférieure d'environ 15% à la surface anatomique.
- Le degré d'excentricité du jet modifie le degré de contraction du flux; un jet très décentré diminue d'environ 15% la surface mesurée par l'équation de continuité.
- Tenir compte de l'arbitraire des limites de catégories dans une maladie qui évolue comme un continuum de la sclérose jusqu'à l'obstruction subtotale.
- En salle d'opération, l'anesthésie générale, la ventilation en pression positive, l'ouverture de la cage thoracique et la péricardotomie modifient les conditions de charge et la contractilité ventriculaire. La surface d'ouverture aortique varie inversément avec la pression artérielle à cause des modifications du flux transvalvulaire [21]. Le gradient moyen est inférieur de 6-7 mmHg et la surface d'ouverture surestimée de 0.1 cm2 par rapport à l'examen préopératoire [33]. Le rapport VTICCVG / VTIVAo est par contre peu modifié. Les mesures faites en 3D sont plus fiables [9].
- En préopératoire, procéder à un écho de stress en situation de bas débit/bas gradient avec sténose apparemment serrée.
- Différenciation entre sténose vraie avec dysfonction du VG (indication au RVA) et pseudosténose (indication douteuse).
- Différenciation entre réserve fonctionnelle positive (indication au RVA) et absence de réserve fonctionnelle (mortalité élevée, préférence pour le TAVI).
- Compléter l'échocardiographie par un examen complémentaire.
- Echo 3D: planimétrie de la surface d'ouverture de la valve aortique, planimétrie de la CCVG.
- CT-scan: mesure exacte de la CCVG, mesure du score calcique.
- IRM: fonction myocardique, fibrose.
- Evaluer les facteurs parlant en faveur du RVA, même chez un patient asymptomatique.
- Vmax ≥ 5 m/s.
- Calcification massive.
- Gradient de pression moyen augmentant de > 20 mmHg sous dobutamine.
L'anesthésiste peut se trouver confronté à ce genre d'évaluation en salle d'opération lors de pontages aorto-coronariens (PAC) ou de polyvalvulopathie et de découverte d'une sténose aortique inattendue ou plus importante que prévue. Cette situation survient dans 2.5% des pontages aorto-coronariens (PAC) [22]. Or la mortalité des PAC est directement proportionnelle au degré de sténose: elle augmente de 2.5 fois lorsque la surface aortique est de 1.0-1.25 cm2 et de 1.8 fois lorsqu'elle est de 1.25-1.5 cm2 [23]. D'autre part, le rétrécissement progresse inexorablement vers la sténose serrée à la cadence de 0.1 cm2/an; il est d'autant plus rapide que le patient est plus âgé et le degré de calcification plus prononcé [16]. Un RVA simultané aux PAC est donc recommandé en cas de sténose modérée-à-sévère ou sévère en présence de signes évolutifs [3,27]. Une sténose aortique modérée dans le cadre d'une polyvalvulopathie peut être due aux erreurs d'interpétation générées par un gradient diminué dans le cadre de situations où le volume systolique est anormalement bas (sténose mitrale, bas débit ventriculaire) ou aux erreurs de calcul dans l'équation de continuté (diamètre de la CCVG trop faible). Un RVA simultanément à la chirurgie mitrale n'est justifié que si la sténose est sévère anatomiquement ou fonctionnellement (surface < 1 cm2/m2, volume systolique abaissé < 35 mL/m2). En cas de bas gradient sur faible fonction ventriculaire, le VG est souvent soulagé par la levée de l'obstacle [30]. Les progrès réalisés dans les interventions par cathétérisme (TAVI) en font une bonne indication dans ces circonstances.
| Quantification de la sténose aortique |
| Planimétrie : indépendante de l’hémodynamique, mais souvent imprécise (calcifications) Equation de continuité: S = (SCCVG • ITVCCVG) / ITVVAo où SCCVG = D2 • 0.785. Mesures ITV indépendantes (Doppler pulsé dans CCVG et Doppler continu dans valve) ou par double enveloppe Gradient de pression: ΔP = 4 • (V2VAo - V2CCVG) Sténose aortique sévère: - S ≤ 0.6 cm2/m2 - Vmax > 4 m/s, ITV ≥ 100 cm, rapport VCCVG / VVAo ≤ 0.25, durée d'accélération / durée d'éjection > 0.4 - ΔPmoy ≥ 40 mmHg La sténose aortique serrée avec faible gradient de pression sur dysfonction du VG est une indication à une épreuve de stress à la dobutamine: - Sténose anatomique fixe : Vmax ↑ dans CCVG et ↑ dans VAo, VCCVG/VVAo reste ≤ 0.25 - Sténose fonctionnelle : Vmax ↑ dans CCVG mais non dans VAo (meilleure ouverture), le rapport VCCVG/VVAo ↑ > 0.3 - Test invalide en l'absence de réserve fonctionnelle |
| Messages pour le chirurgien en cas de sténose aortique |
| Description : nombre de cuspides (éventuelle bicuspidie), position, fusion, calcifications, coulée calcique sur le feuillet antérieur de la mitrale, présence d’une IM (mécanisme), calcifications pendulaires, déchirures, calcifications de l’aorte ascendante, localisation des ostia coronariens Dimensions : planimétrie de la valve, diamètres (mesurés en long axe 120°) de la CCVG, de l’anneau aortique, des sinus de Valsalva, de la jonction sino-tubulaire, de l’aorte ascendante, distance anneau aortique – jonction sinotubulaire Flux Doppler : présence d’une IA associée, Vmax aortique (DC), gradients moyen et maximal, Vmax CCVG (DP ou double enveloppe au DC) ; utiliser ΔP = 4 • (V2VAo - V2CCVG) si VCCVG ≥ 1.5 m/s VG : hypertrophie, Vmax dans CCVG, distance point de coaptation mitral – septum (systole), épaisseur du septum au niveau de la CCVG et proéminence de l’éperon septal (évaluation de la myectomie nécessaire à limiter le risque de sténose dynamique après RVA) VD : fonction et dimension, état de la valve tricuspidienne (indication à une plastie si diamètre de l'anneau > 4 cm) DP: Doppler pulsé. DC: Doppler continu. |
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
- ADDA J, MIELOT C, GIORGI R, et al. Low flow/low gradient severe aortic stenosis despite normal ejection fraction is associated with severe left ventricular dysfunction as assessed by speckle-tracking echocardiography: a multicenter study. Circ Cardiovasc Imaging 2012; 5:27-35
- AMATO MC, MOFFA PJ, WERNER KE, et al. Treatment decision in asymptomatic aortic valve stenosis: role of exercise testing. Heart 2001; 86:381-6
- BAUMGARTNER H, HUNG J, BERMEJO J, et al. Recommendations on the echocardiographic assessment of aortic valve stenosis: a focused update from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. Eur Heart J Cardiovasc Imaging 2017; 18:253-75
- BAX JJ, DELGADO V. Advanced imaging in valvular heart disease. Nat Rev Cardiol 2017; 14:209-23
- BONOW RO, CARABELLO B, KARU C, et al. ACC/AHA guidelines for the management of patients with valvular heart disease: Executive summary. Circulation 2006; 114:284-91
- CLAVEL MA, ENNEZAT PV, MARECHAUX S, et al. Stress echocardiography to assess stenosis severity and predict outcome in patients with paradoxical low-flow, low-gradient aortic stenosis and preserved LVEF. JACC Cardiovasc Imaging 2013; 6:175-83
- CLAVEL MA, MESSIKA-ZEITOUN D, PIBAROT P, et al. The complex nature of discordant severe calcified aortic valve disease grading: new insights from combined Doppler echocardiographic and computed tomographic study. J Am Coll Cardiol 2013; 62:2329-38
- DEFILIPPI CR, WILLETT DL, BRICKNER ME, et al. Usefullness of dobutamine echocardiography in distinguishing severe from nonsevere valvular aortic stenosis in patients with depressed left ventricular function and low transvalvular gradients. Am J Cardiol 1995; 75:191-4
- FERNANDO RJ, GARNER C, SLAUGHTER TF. A review of the 2017 American Society of Echocardiography Guidelines for evaluation of aortic stenosis: considerations for perioperative echocardiography. J Cardiothorac Vasc Anesth 2018; 32:1800-14
- FOUGERES E, TRIBOUILLOY C, MONCHI M, et al. Outcomes of pseudo-severe aortic stenosis under conservative treatment. Eur Heart J 2012; 33:2426-33
- GARCIA D, PIBAROT P, LANDRY C, et al. Estimation of aortic valve effective orifice area by Doppler echocardiography: Effects of valve inflow shape and flow rate. J Am Soc Echocardiogr 2004; 17:756-65
- GASPAR T, ADAWI S, SACHNER R, et al. Three-dimensional imaging of the left ventricular outflow tract: impact on aortic valve area estimation by the continuity equation. J Am Soc Echocardiogr 2012; 25:749-57
- HUI S, MAHMOOD F, MATYAL R. Aortic valve area – Technical communication: continuity and Gorlin equations revisited. J Cardiothorac Vasc Anesth 2018; 32:2599-606
- KEARNEY LG, LU K, ORD M, et al. Global longitudinal strain is a strong independent predictor of all-cause mortality in patients with aortic stenosis. Eur Heart J Cardiovasc Imaging 2012; 13:827-33
- KEMPNY A, DILLER GP, KALESCHKE G, et al. Longitudinal left ventricular 2D strain is superior to ejection fraction in predicting myocardial recovery and symptomatic improvement after aortic valve implantation . Int J Cardiol 2013; 167:2239-43
- KUME T, KAWAMOTO T, OKURA H, et al. Rapide progression of mild to moderate aortic stenosis in patients older than 80 years. J Am Soc Echocardiogr 2007; 20:1243-6
- LANCELLOTTI P, LEBOIS F, SIMON M, et al. Prognostic importance of quantitative exercise Doppler echocardiography in asymptomatic aortic valvular stenosis. Circulation 2005; 112 Suppl I:I1377-82
- LASKEY WK, KUSSMAUL WG, NOORDEGRAAF A. Systemic arterial response to exercise in patients with aortic valve stenosis. Circulation 2009, 119:996-1004
- LAUTEN A, ZAHN R, HORACK M, et al. Transcatheter aortic valve implantation in patients with low-flow, low-gradient aortic stenosis. JACC Interv 2012; 5:552-9
- LIN SS, ROGER VL, PASCOE R, et al. Dobutamine stress Doppler hemodynamics in patients with aortic stenosis: feasibility, safety, and surgical correlations. Am Heart J 1998; 136:1010-6
- LITTLE SH, CHAN KL, BURWASH IG. Impact of blood pressure on the Doppler echocardiographic assessment of severity of aortic stenosis. Heart 2007; 93:848-55
- MAHMOOD F, FRITSCH M, MASLOW A. Unanticipated mild-to moderate aortic stenosis during coronary artery bypass graft surgery: scope of the problem and its echocardiographic evaluation. J Cardiothorac Vasc Anesth 2009; 23:869:77
- MALDONADO Y, SINGH S, AUGOUSTIDES JG, et al. Moderate aortic stenosis and coronary artery bypass grafting: clinical update for the perioperative echocardiographer. J Cardiothorac Vasc Anesth 2015; 29:1384-90
- MINNERS J, ALLGEIER M, GOHLKE-BAERWOLF C, et al. Inconsistent grading of aortic valve stenosis by current guidelines: haemodynamic studies in patients with apparently normal left ventricular function. Heart 2010; 96:1463-8
- MONIN JL, QUERE JP, MONCHI M, et al. Low-gradient aortic stenosis: Operative risk stratification and predictors for long-term outcome – A multicenter study using dobutamine stress hemodynamics. Circulation 2003; 108:319-26
- NASEEM T, SONG M, IANCHULEV S, et al. The echocardiographic evaluation of a bicuspid aortic valve: the effect of jet excentricity and left ventricular outflow tract geometry on the effective orifice area. J Cardiothorac Vacs Anesth 2014; 28:423-7
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- O'BRIAN B, et al. Integration of 3D imaging data in the assessment of aortic stenosis: impact on classification of disease severity. Circ Cardiovasc Imaging 2011; 4:566-73
- PIERARD LA, LANCELLOTTI P. Stress testing in valve disease. Heart 2007; 93:766-72
- RAMAKRISHNA H, GUTSCHE JT, PATEL PA, et al. Options for incidental moderate aortic stenosis during concomittant valve surgery: a clinical update for the perioperative echocardiographer. J Cardiothorac Vasc Anesth 2016; 30:252-7
- TRIBOUILLOY C, LEVY F, RUSINARU D, et al. Outcome after aortic valve replacement for low-flow/low-gradient aortic stenosis without contractile reserve on dobutamine stress echocardiography. J Am Coll Cardiol 2009; 53:1865-73
- VAHANIAN A, ALFIERI O, ANDREOTTI F, et al. Guidelines on the management of valvular heart disease (version 2012). The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2012; 33:2451-96
- WHITENER G, McKENZIE J, AKUSHEVICH I, et al. Discordance in grading methods of aortic stenosis by pre-cardiopulmonary bypass transesophageal echocardiography. Anesth Analg 2016; 122:953-8
- ZOGHBI WA, ADAMS D, BONOW RO, et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the ASE developped in collaboration with the SCMR. J Am Soc Echocardiogr 2017; 30:303-71





























