Step 4 of 7
Cardiopathies congénitales
Les cardiopathies congénitales offrent tout un éventail de situations hémodynamiques différentes; le risque de morbi-mortalité des patientes souffrant d'une de ces affections est extrêmement variable selon les pathologies et les situations (Tableau 22.6). D'autre part, les modifications importantes liées à la grossesse (augmentation de 50% du volume circulant, augmentation de 30-40% du DC et de la fréquence, abaissement des RAS) ont une influence majeure, mais elle aussi variable, sur la circulation des malformations congénitales. Avec les progrès de la chirurgie cardiaque pédiatrique, le nombre de ces malades tend à augmenter: les congénitaux représentent actuellement les deux tiers des cardiopathies rencontrées pendant la grossesse en Europe, mais moins du tiers dans les pays émergents [24].
Lorsque la maladie est bien tolérée, la mortalité maternelle est < 1%; mais elle grimpe jusqu'à 38% dans les cas d'hypertension pulmonaire sévère (HTAP) ou de cyanose importante (SaO2 < 85%) [5,25]. Le décès survient souvent plusieurs jours après la délivrance [21]. Le taux de complications cardiovasculaires pendant la grossesse oscille entre 11% et 33% (moyenne 12%): décompensation cardiaque, cyanose, poussée d’HTAP, thrombo-embolie, AVC, arythmie, endocardite [4,20,22]. Celui des complications obstétricales voisine 30% [6]. La mortalité infantile moyenne est de 4%; elle s’élève jusqu’à 40-65% dans les cardiopathies cyanogènes sévères et le syndrome d’Eisenmenger (hypertension pulmonaire fixée) [5]. Le taux moyen de prématurité est de 16-20%, ce qui est plus de quatre fois supérieur aux taux normaux dans les pays occidentaux; dans les pathologies sévères, la prématurité survient dans 22-65% des cas [3,4]. Les complications fœtales (prématurité, poids de naissance bas, fausse-couche et décès) sont proportionnelles au bas débit utérin et au degré de cyanose de la mère: lorsque la SaO2 maternelle est > 90%, le taux de survie fœtale est de 92%, mais lorsque la SaO2 est < 85%, il n'est plus que de 12% [14,20].
Dans les pays industrialisés, la plupart des cardiopathies congénitales sont opérées dans l'enfance de manière à minimiser les séquelles. A l'exception de la CIA, de la petite CIV et du canal artériel, où la récupération est totale, ces interventions corrigent la malformation mais ne transforment pas pour autant le cœur en un organe normal. La plupart du temps, il subsiste une dysfonction ventriculaire, un shunt, un rétrécissement ou une insuffisance, et un risque élevé d'arythmies.
Hormis des dilatations de l'aorte ascendante, qui requièrent une césarienne, l'accouchement par voie basse est possible pour la plupart des cardiopathies congénitales, mais la décision reste fonction des pathologies et de l'éventuelle souffrance foetale. D'une manière générale, la phase de travail active avec ses manœuvres de Valsalva et ses autotransfusions à chaque contraction est potentiellement dangereuse; il est préférable d'accélérer le travail par forceps ou ventouse. L'analgésie péridurale est capitale pour limiter les décharges de catécholamines et assurer une stabilité hémodynamique, à la condition de procéder à une installation lente du bloc. L'addition d'un opiacé renforce l'effet antalgique et réduit les perturbations circulatoires par rapport à un anesthésique local seul; il est prudent de ne pas adjoindre d'adrénaline. La rachianesthésie, par contre, fait chuter brusquement les résistances artérielles systémiques et diminue la précharge de manière abrupte, ce qui est mal toléré dans les situations où la vasodilatation artérielle systémique aggrave la situation, comme en cas de shunt droit – gauche et de shunt bi-directionnel avec hypertension artérielle pulmonaire (HTAP) ou sténose pulmonaire. Par contre, elle est recommandée dans les situations où il faut plutôt baisser les RAS comme les shunts gauche – droit (CIA, CIV, canal artériel) [6,9]. Manipulée avec doigté, la combinaison rachi-péridurale est concevable si les RAS sont bien maintenues [6]. Lors d'HTAP ou de situations où il est souhaitable de baisser les RAP, une anesthésie générale avec hyperventilation et nébulisation de vasodilatateurs par inhalation est avantageuse; toutefois, une anesthésie péridurale avec un bloc d'installation très progressive donne d'excellents résultats, pour autant que la précharge du VD et les RAS soient correctement maintenues [6,16].
Un cathéter artériel et une voie centrale (PVC) sont utiles pour ajuster les vasopresseurs et la volémie nécessaires au maintien de la pression de perfusion utérine et à l'équilibre d'un shunt droit → gauche ou de la potentielle défaillance droite en cas d'hypertension pulmonaire. Chez les mères cyanosées, l'apport d'O2 et les RAS doivent être suffisants pour assurer la SaO2 la plus haute possible. La précharge peut varier considérablement au cours d'une délivrance: elle augmente brusquement par autotransfusion maternelle à chaque contraction utérine, et baisse dangereusement en cas d'hémorragie. Ces variations sont mal tolérées chez les congénitaux pour plusieurs raisons: une sténose limite le débit, une dysfonction ventriculaire empêche l'adaptation aux variations de volémie, un shunt soustrait une partie du volume circulant à la circulation systémique, une hypertension pulmonaire maintient un débit pulmonaire fixe et bas. L'hypovolémie se traduit alors par une désaturation artérielle.
Alors que la grossesse et l'accouchement se déroulent en général de manière aisée dans les affections de classe I et II (Tableau 22.6), il est capital que les patientes souffrant de pathologies graves (classe > II) soient suivies dans des centres spécialisés qui offrent toutes les compétences nécessaires en obstétrique, en anesthésie et en cardiologie congénitale [1,3,6,22]. La technique d’anesthésie pour les parturientes souffrant de cardiopathie congénitale est déterminée par les contraintes hémodynamiques de la pathologie. Elles sont décrites en détail au Chapitre 15 (Anesthésie lors de cardiopathies congénitales de l’adulte) et sont résumées ci-après.
| Grossesse et cardiopathies congénitales |
|
Les modifications hémodynamiques de la grossesse affectent de manière variable les cardiopathies congénitales. Les risques varient selon les pathologies.
- Mortalité maternelle: < 1% dans les cas simples, jusqu'à 38% si HTAP ou cyanose sévères
- Complications obstétricales: 30%
- Mortalité fœtale: moyenne 4%, jusqu'à > 50% si HTAP ou cyanose sévères
- Taux de prématurité: moyenne 16%, jusqu'à 60% dans les pathologies graves
Les complications foetales sont proportionnelles au bas débit utérin et à la profondeur de la cyanose.
Facteurs déterminant majeurs de la gravité du pronostic :
- SpO2 < 90% au repos
- PAPmoy > 25 mmHg
- Dysfonction ventriculaire
- Anamnèse de décompensation
L’ALR rachidienne est conseillée dans les shunts G-D simples (CIA, CIV, canal artériel). Dans les shunts D-G cyanogènes, dans les shunts correctifs, dans l’HTAP et dans les sténoses (pulmonaire, aortique, chambre de chasse, coarctation), les RAS doivent être impérativement maintenues, d'où la recommandation d'une installation lente du bloc (péridurale avec anesthésique local + opiacé); la rachianesthésie est déconseillée.
Indications à la césarienne: dilatation de l'aorte, pathologies ne tolérant pas l'hypervolémie (autotransfusion pendant les contractions) ni l'augmentation de la pression intrathoracique (Valsalva), souffrance fœtale sur bas débit ou cyanose (dysfonction ventriculaire, shunt important, HTAP).
|
Shunts gauche → droit
La communication interauriculaire (CIA), la communication interventriculaire (CIV) et le canal artériel (CA) sont des shunts G-D bien tolérés lorsqu'ils sont de petite taille; ils ne sont pas cyanogènes. Leur débit augmente lorsque les RAS s'élèvent (Figure 22.6); la vasodilatation de la grossesse leur est donc favorable puisqu'elle les diminue. A la faveur d'une augmentation de pression dans le circuit droit (manœuvre de Valsalva, effort du travail), la minime composante D-G qui survient normalement pendant chaque cycle cardiaque s'amplifie (Figure 22.7). Il est donc important d'éviter scrupuleusement toute injection intraveineuse accidentelle d'air; il est prudent d'utiliser du NaCl au lieu d'air dans la seringue de ponction péridurale pour tester la perte de résistance [15]. Comme la baisse des RAS diminue ces shunts, la rachianesthésie et la péridurale sont recommandées. Un shunt G-D représente un état de relative hypervolémie; la surcharge de volume à l'occasion des contractions utérines peut entrainer une décompensation ventriculaire.
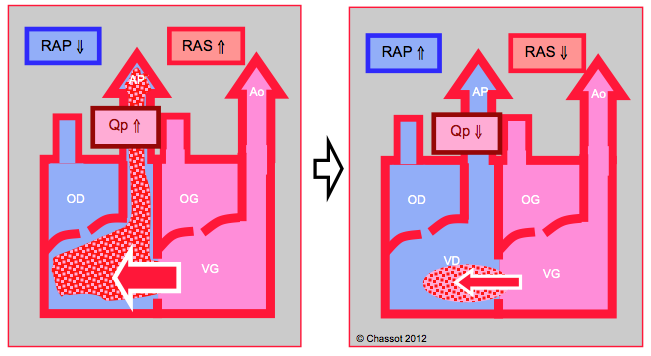
Figure 22.6 : Shunt gauche - droit. Il augmente lorsque les RAS s’élèvent et que les RAP baissent ; le flux pulmonaire (Qp) est alors excessif. Le shunt diminue si les RAS baissent et si les RAP augmentent.
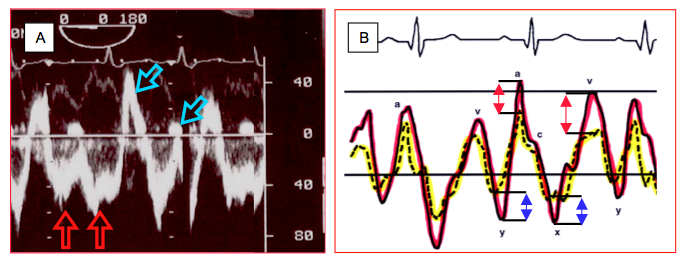
Figure 22.7 : Flux dans une CIA. A : Représentation spectrale du flux (ETO); le shunt est à large prédominance gauche - droit (flux en dessous de la ligne de base, s'éloignant du capteur situé dans l'oesophage), avec deux composantes (flèches rouges); il présente aussi deux petites composantes droite - gauche au-dessus de la ligne de base (flèches vertes). B : Représentation des courbes de pression de l'OG (rouge) et de l'OD (jaune). Les variations de pression sont plus amples à gauche. De ce fait, la POG est plus élevée que la POD lors des pics de pression, mais plus basse lors de nadirs de pression. Le flux sera donc gauche - droit pendant les ondes a et v (flèches rouges), mais droite - gauche pendant les descentes x et y (flèches bleues).
Les shunts palliatifs (Blalock-Taussig, Waterston) visent à augmenter un débit pulmonaire insuffisant pas un apport systémique depuis l'aorte ou l'une de ses branches. Le débit pulmonaire est donc d'autant meilleur que les RAS sont élevées (Figure 22.8). Il faut donc éviter toute baisse des RAS; la péridurale est possible si l'installation du bloc est très progressive et la sympathicolyse minimale.
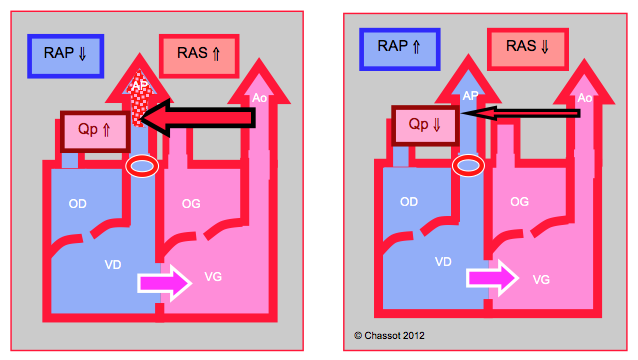
Figure 22.6 : Shunt gauche - droit. Il augmente lorsque les RAS s’élèvent et que les RAP baissent ; le flux pulmonaire (Qp) est alors excessif. Le shunt diminue si les RAS baissent et si les RAP augmentent.
Figure 22.7 : Flux dans une CIA. A : Représentation spectrale du flux (ETO); le shunt est à large prédominance gauche - droit (flux en dessous de la ligne de base, s'éloignant du capteur situé dans l'oesophage), avec deux composantes (flèches rouges); il présente aussi deux petites composantes droite - gauche au-dessus de la ligne de base (flèches vertes). B : Représentation des courbes de pression de l'OG (rouge) et de l'OD (jaune). Les variations de pression sont plus amples à gauche. De ce fait, la POG est plus élevée que la POD lors des pics de pression, mais plus basse lors de nadirs de pression. Le flux sera donc gauche - droit pendant les ondes a et v (flèches rouges), mais droite - gauche pendant les descentes x et y (flèches bleues).
Les shunts palliatifs (Blalock-Taussig, Waterston) visent à augmenter un débit pulmonaire insuffisant pas un apport systémique depuis l'aorte ou l'une de ses branches. Le débit pulmonaire est donc d'autant meilleur que les RAS sont élevées (Figure 22.8). Il faut donc éviter toute baisse des RAS; la péridurale est possible si l'installation du bloc est très progressive et la sympathicolyse minimale.
Figure 22.8 : Shunt correctif gauche - droit pour augmenter le débit pulmonaire (Qp) lors de sténose pulmonaire. Son débit diminue lorsque les RAS baissent et augmente avec celles-ci.
| Shunt gauche - droit |
|
Hémodynamique recherchée en anesthésie:
- Baisser les RAS
- Eviter l'hypervolémie
ALR rachidienne bien adaptée
|
Hypertension pulmonaire
L'hypertension artérielle pulmonaire (HTAP) est définie par une pression moyenne (PAPm) supérieure à 25 mmHg dans l’AP au repos, et des RAP > 240 dynes•s•cm-5 ou > 3 U Wood (valeur normale : 60-120 dynes•s•cm-5, < 2 U Wood) (voir Chapitre 12, Hypertension pulmonaire). Les patientes souffrant d'HTAP (4-10% des congénitaux adultes) se caractérisent par une perte complète de la compliance hémodynamique dans la circulation droite. Elles présentent une physiopathologie particulière [7].
- Le débit pulmonaire est abaissé et relativement fixe ; il ne peut pas augmenter proportionnellement à la demande en O2, d’où cyanose à l’effort. Toute élévation de la précharge ou du débit cardiaque, comme pendant le travail, se traduit par une élévation importante de la PAP, pour autant que le VD ne soit pas dysfonctionnel.
- Face à l’augmentation chronique de sa postcharge, le VD se dilate et s’hypertrophie (HVD). Plus il est hypertrophié, plus le VD se comporte comme le VG ; il tolère l’augmentation de postcharge mais son débit devient dépendant de la précharge. Il ne peut plus amortir les variations du retour veineux en maintenant le débit pulmonaire constant; l’hypovolémie conduit à une baisse du débit pulmonaire et à une hypoxémie.
- En diastole, la pression du VD hypertrophié et surchargé est supérieure à celle du VG ; le septum interventriculaire bombe dans le VG et réduit le remplissage diastolique gauche; l’élévation de la postcharge gauche (vasoconstriction artérielle systémique) tend à replacer le septum dans sa position physiologique, ce qui soutient l'éjection droite.
- Une hypotension systémique peut compromettre la perfusion coronarienne droite en réduisant la composante diastolique du flux coronaire vers le VD ; un vasoconstricteur systémique est requis pour parer au risque ischémique.
- Si le foramen ovale est perméable, un shunt droite → gauche cyanogène peut s’installer à la faveur d’une augmentation excessive de la POD.
- Malgré l’épaississement des parois artérielles pulmonaires, les petits vaisseaux artériolaires périphériques conservent une réactivité vasculaire ; les RAP peuvent encore augmenter par hypoxémie, hypercarbie, acidose, hypothermie ou stress sympathique.
- En cas d'anémie, la baisse du transport d’O2 ne peut pas être compensée par une augmentation du débit pulmonaire (seuil de transfusion Hb ≥ 100 g/L).
- Les oestrogènes et la progestérone ont un effet vasodilatateur pulmonaire, mais la prolactine cause une vasoconstriction artérielle pulmonaire; avec la baisse des premières et l'augmentation de la seconde, le postpartum est une période dangereuse [23].
La mortalité maternelle, qui était de 35-50% il y a quelques années, s'est abaissée jusqu'à 16% actuellement avec les nouveaux traitements: NO, prostacyclines, inhibiteurs des phosphodiestérases-5, bloqueurs calciques, anticoagulation; les antagonistes de l'endothéline sont tératogènes et sont donc contre-indiqués dans la grossesse [2,10,19]. Toutefois, la mortalité de la mère reste de l'ordre de 25% et celle de l'enfant de l'ordre de 40% dans le syndrome d'Eisenmenger (HTAP fixe sur shunt G-D massif, avec PAP voisine de la pression systémique et shunt devenu bidirectionnel); dans ce cas, la baisse des RAS aggrave la cyanose par augmentation de la composante D-G du shunt [3]. Le risque de mortalité, maximal pendant les 72 heures postpartum, reste élevé pendant plusieurs semaines, puisque les trois quarts des décès ont lieu pendant le premier mois après l'accouchement [2,23]. Ces données très sombres font de l'HTAP sévère une contre-indication à la maternité et une indication à interrompre la grossesse lorsqu'elle survient [10,22].
Si l'HTAP est modérée et que la grossesse est menée à terme, un accouchement pas voie basse est possible, mais la césarienne est préférable [10]. Elle s'impose en cas d'instabilité maternelle ou fœtale car l'effort du travail (Valsalva, hypervolémie) est mal supporté; une délivrance élective à la 32-34ème semaine est souvent conseillée [5,19,23]. La prise en charge anesthésique est difficile et sujette à discussion (voir Chapitre 12, Insuffisance droite). La rachianesthésie est déconseillée à cause de ses effets hémodynamique majeurs et brusques [23]. La péridurale avec installation lente du bloc de manière à éviter la baisse des RAS est généralement préférée à l'anesthésie générale, qui a donné de moins bons résultats dans plusieurs séries [5,19]. Cependant, une anesthésie générale permet l'hyperventilation (baisse des RAP par hypocapnie) et l'administration de vasodilatateurs pulmonaires par inhalation (NO, prostaglandines) (voir Chapitre 12, Traitement de l'HTAP) [23]; comme le VD est hypertrophié à cause de la PAP élevée, l'augmentation de postcharge représentée par la ventilation en pression positive est négligeable. Il faut éviter tout ce qui augmente les RAP (hypoxémie, hypercarbie, douleur, acidose, hypothermie, N2O, desflurane) et maintenir les RAS élevées (noradrénaline). L'oxytocine augmente les RAP et baisse les RAS; comme tous les utérotoniques, elle doit être administrée avec infiniment de précaution (perfusion < 2 UI/min) et jamais en bolus [23]. La SpO2 renseigne sur le degré de shunt D-G; un cathéter artériel et une voie centrale (PVC) sont nécessaires à la prise en charge [18,21].
| Hypertension artérielle pulmonaire (HTAP) |
|
Hémodynamique recherchée en anesthésie:
- Optimiser la précharge du VD (selon PVC)
- Maintenir les RAS élevées
- Abaisser les RVP
- Soutenir la contractilité du VD si nécessaire (dobutamine, milrinone)
Le mode d'accouchement en général recommandé est la césarienne élective sous péridurale avec installation très lente du bloc, mais l'anesthésie générale n'est pas contre-indiquée.
|
Shunts droit → gauche
Les shunts D-G sont cyanogènes et sont présents dans de multiples pathologies. D'une manière générale, la cyanose augmente lorsque les RAS baissent (Figure 22.9).
- Flux pulmonaire abaissé, par exemple par obstruction sur la voie droite (tétralogie de Fallot); pour diminuer le shunt D-G, il faut diminuer les RAP et augmenter les RAS. La SpO2 surveille adéquatement le rapport Qp/Qs.
- Flux systémique abaissé, comme l'hypoplasie du cœur gauche ou de l'arc aortique. Ces cas sont opérés dans l'enfance ou ne survivent pas jusqu'à l'âge adulte.
- Shunt cyanogène mixte, rencontré dans les larges CIV, le ventricule unique (voir ci-dessous Circulation de Fontan), ou la transposition des gros vaisseaux. La répartition du flux entre l’aorte et l’AP est fonction directe de l’équilibre entre les résistances artérielles systémiques et pulmonaires. Le but n’est pas d’obtenir la SaO2 la plus élevée possible, mais un rapport Qp/Qs voisin de 1:1 ; ceci correspond souvent à une SaO2 de 75-85%. Si l’on recherchait la meilleure SaO2, on courrait le risque d’un flux pulmonaire excessif ; celui-ci entraînerait une décompensation ventriculaire et un bas débit systémique accompagné d’une ischémie et d’une acidose métabolique.
Figure 22.9 : Shunt droit - gauche. Il augmente lorsque les RAS baissent, ce qui diminue le flux artériel pulmonaire (Qp). Le shunt diminue si les RAS augmentent et si les RAP baissent ; de ce fait, le flux pulmonaire augmente et la SaO2 s’améliore.
Ces pathologies ne permettent pas de mener une grossesse à terme, mais on rencontre à l'âge adulte des cas exceptionnellement compensés, comme une tétralogie de Fallot "rose" grâce à un large flux collatéral bronchique, ou des cas opérés dans l'enfance mais avec un shunt résiduel important.
| Shunts droit – gauche et mixtes |
|
Hémodynamique recherchée en anesthésie:
- Maintenir les RAS élevées
- Eviter l'augmentation des RAP (hypoxémie, hypercarbie, acidose, hypothermie, douleur)
- Maintenir la précharge
- La SpO2 renseigne sur le rapport Qp/Qs
|
Tétralogie de Fallot
La tétralogie de Fallot est constituée de 4 éléments: 1) sténose pulmonaire et/ou de la chambre de chasse droite, 2) CIV haute, 3) aorte à cheval sur la CIV, et 4) hypertrophie du VD (Figure 22.10) Avec la cyanose sévère qui lui est liée, cette pathologie est une contre-indication à une grossesse. Une fois la cardiopathie traitée, par contre, la grossesse est possible et bien tolérée. Les patientes présentent toutefois de fréquentes lésions résiduelles de la correction chirurgicale: insuffisance ou sténose de la voie pulmonaire avec surcharge de volume ou de pression du VD, CIV résiduelle, insuffisance aortique, arythmies. La dilatation du VD fait basculer le septum interventriculaire dans le VG et réduit l'expansion diastolique de ce dernier, qui souffre d'hypovolémie. Plus ces séquelles sont importantes, plus les risques sont élevés pour la mère et pour l'enfant [3,6].
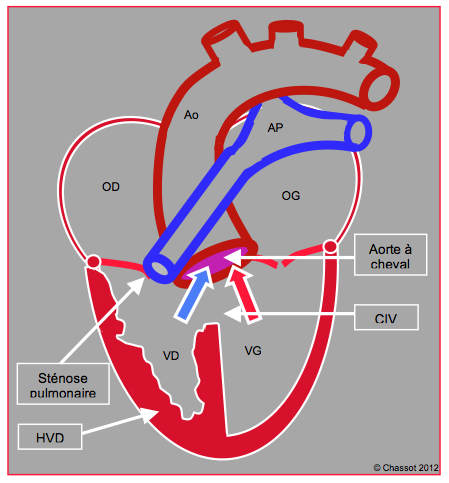
Figure 22.10 : Schéma de tétralogie de Fallot, qui comprend 4 anomalies : la valve aortique est à cheval (1) sur une large CIV périmem-braneuse (2), la valve et l'artère pulmonaire sont sténosées (3) et le VD est hypertrophié. L’aorte reçoit un mélange de sang artérialisé du VG et de sang veineux en provenance du VD à travers la CIV.
Il arrive que la pathologie ne soit pas trop sévère et permette la survie à l'âge adulte grâce à un réseau collatéral issu de l'aorte et vascularisant les poumons; le shunt D-G domine alors l'hémodynamique, et le degré de cyanose est fonction inverse des RAS. Ainsi, la baisse des RAS et le travail de l’accouchement aggravent la cyanose et sont responsables d’une hypoxémie fœtale. En cas d'hypovolémie, la composante D-G du shunt augmente, comme lors d'une baisse de pression systémique. L'anesthésie générale est préférée. La péridurale est possible avec une installation très progressive du bloc et un maintien de la précharge du VD et des RAS. La rachianesthésie est contre-indiquée (baisse excessive des RAS). En cas de crise hypoxique, on administre de l'esmolol pour diminuer la sténose dynamique de la CCVD et de la phényléphrine ou de la noradrénaline pour augmenter le débit pulmonaire par la CIV et les collatérales; augmenter la FiO2 est insuffisant.
Il arrive que la pathologie ne soit pas trop sévère et permette la survie à l'âge adulte grâce à un réseau collatéral issu de l'aorte et vascularisant les poumons; le shunt D-G domine alors l'hémodynamique, et le degré de cyanose est fonction inverse des RAS. Ainsi, la baisse des RAS et le travail de l’accouchement aggravent la cyanose et sont responsables d’une hypoxémie fœtale. En cas d'hypovolémie, la composante D-G du shunt augmente, comme lors d'une baisse de pression systémique. L'anesthésie générale est préférée. La péridurale est possible avec une installation très progressive du bloc et un maintien de la précharge du VD et des RAS. La rachianesthésie est contre-indiquée (baisse excessive des RAS). En cas de crise hypoxique, on administre de l'esmolol pour diminuer la sténose dynamique de la CCVD et de la phényléphrine ou de la noradrénaline pour augmenter le débit pulmonaire par la CIV et les collatérales; augmenter la FiO2 est insuffisant.
| Tétralogie de Fallot |
|
Hémodynamique recherchée en anesthésie (TdF opérée):
- Eviter la surcharge du VD (hypervolémie, PAP élevée)
- Diminuer les RAP
- Maintenir le rythme sinusal
- Si IA majeure: baisser les RAS et élever la fréquence cardiaque
TdF non-opérée ayant survécu jusqu'à l'âge adulte:
- Elever les RAS (↑ SpO2)
- Eviter l'hypovolémie
- Diminuer la contractilité de la CCVD (esmolol)
|
Circulation de Fontan
La circulation de Fontan est une palliation réalisée dans les cas de ventricule unique sur atrésie du VD. Elle consiste à dérouter le flux des veines caves directement dans l'artère pulmonaire en court-circuitant le VD atrétique. Le ventricule unique pourvoit à la circulation systémique et à la circulation pulmonaire en série, puisque cette dernière est assurée par l'écoulement passif du sang veineux central à travers les poumons; le flux pulmonaire dépend donc d'une PVC élevée et d'une pression intrathoracique basse (Figure 22.11). La survie des enfants opérés est actuellement de 83% à 20 ans, donc en âge de procréer [13]. Cependant, ce type de circulation s'accommode difficilement des exigences hémodynamiques de la grossesse; le taux de complications maternelles est de 10% et celui de fausses-couches de 30-50% [5,6]. Pour la prise en charge, les contraintes circulatoires sont majeures [1].
- La PVC doit rester élevée (précharge haute, volémie maintenue);
- La pression intrathoracique doit rester basse; la loco-régionale est préférable à l'anesthésie générale (respiration spontanée);
- Vu le risque thrombotique, les malades sont en général anticoagulées;
- Toute augmentation des RAP est à éviter; les analogues de la prostaglandine sont proscrits et l'oxytocine ne doit être administrée qu'en perfusion très lente.
Figure 22.11 : Atrésie tricuspidienne et sa palliation selon Fontan. A : La valve tricuspide est une membrane fibro-musculaire (flèche verte), le VD est hypoplasique et communique avec le VG par une petite CIV (flèche bleue). Le VG est l’unique ventricule fonctionnel (VU) ; il reçoit du sang venant de l’OG par la valve mitrale et communique avec l’aorte et l’AP. B : Le sang veineux passe de l’OD dans l’OG par une CIA, où il se mélange au sang artérialisé des veines pulmonaires. Ce mélange est expulsé dans l’aorte par le ventricule unique. C : tunnel latéral de Fontan ; le sang de la veine cave inférieure (VCI) se draine dans l’OD puis dans l’artère pulmonaire (AP) par l’anastomose entre la racine de la VCS et l’artère pulmonaire droite (APD) ; la CIA sert de soupape en cas de surpression. D : conduit de Fontan externe (tube prothétique) qui achemine le sang de la VCI dans l’AP ; il est souvent fenestré dans l’OD pour éviter une surcharge. En C et en D, le shunt de Glenn est une anastomose termino-latérale de la veine cave supérieure (VCS) à l'artère pulmonaire droite (APD).
| Circulation de Fontan |
|
Hémodynamique recherchée en anesthésie:
- Maintien de la normovolémie
- Maintien de PVC haute et RAP basse (hyperoxie, hypocarbie, alcalose, analgésie)
- Maintien de P intrathoracique basse (respiration spontanée)
- Maintien des RAS (selon SpO2)
ALR rachidienne recommandée, éviter l'anesthésie générale
|
Pathologie de l'aorte
La dissection aiguë de type A est un événement catastrophique qui est associé à la bicuspidie aortique, à la maladie de Marfan, au syndrome d'Ehler-Danlos et au syndrome de Turner. Le risque est clairement aggravé par la grossesse; il est maximal pendant le 3ème trimestre et le postpartum. Il est directement proportionnel au degré d'ectasie de l'aorte ascendante, sauf dans le syndrome d'Ehler-Danlos où la rupture peut survenir sans dilatation [5,22].
- Syndrome de Marfan ou de Turner: risque de dissection 1% si diamètre aortique < 40 mm, 10% si diamètre > 40 mm. Un diamètre > 45 mm ou une augmentation de > 5 mm est une indication à intervenir chirurgicalement de manière élective, si possible au 3ème trimestre dans la foulée d'une césarienne [12]. En cas de chirurgie au 2ème trimestre, la mortalité maternelle est actuellement < 1% et la mortalité fœtale de 10% [8]. Traitement continu de béta-bloqueur pour freiner l'éjection du VG [22].
- Bicuspidie aortique: un diamètre aortique de > 50 mm est une indication opératoire, car le risque de dissection est 8 fois plus élevé que dans la population générale [17].
- La grossesse est contre-indiquée lorsque le diamètre de l'aorte ascendante est > 45 mm (Marfan) à > 50 mm (bicuspidie) ou > 25 mm/m2 [22].
Un accouchement par voie basse sous péridurale et travail accéléré est possible lorsque le diamètre de l'aorte est < 40 mm (Marfan) ou < 45 mm (bicuspidie). Si la dilatation de l'aorte ascendante est supérieure à ces chiffres ou a augmenté en cours de grossesse, une césarienne est recommandée [8,22]. A noter que 70% des patientes avec un Marfan présentent une ectasie durale lombo-sacrée [11].
La coarctation de l'aorte crée un gradient de pression entre la crosse de l'aorte et l'aorte descendante. La pression artérielle mesurée aux bras n'est pas la pression qui perfuse l'utérus. Le traitement anti-hypertenseur doit donc être ajusté en fonction de la pression aux membres inférieurs afin d'éviter une hypoperfusion utérine. D'autre part, la coarctation est associée à la bicuspidie aortique et amplifie le risque de dissection A [3]. Si elle est serrée, la coarctation limite le débit cardiaque: le volume systolique étant fixé par la sténose, seule l'élévation de la fréquence permet de l'augmenter. Pour l'anesthésie, le but est de maintenir la précharge, les RAS et la fréquence cardiaque légèrement élevées; un cathéter artériel fémoral est très utile pour évaluer la pression artérielle perfusant le système utéro-placentaire [15]. L'anesthésie générale est recommandée pour la césarienne. L'ALR rachidienne est possible pour un accouchement par voie basse à la condition de maintenir les RAS dans la partie inférieure du corps; la péridurale bien contrôlée le permet, mais non la rachianesthésie. Au besoin, une perfusion de noradrénaline compense le bloc sympathique.
| Pathologie de l'aorte ascendante |
|
Dilatation de l'aorte (associée au syndrome de Marfan et à la bicuspidie aortique): risque de dissection (type A) et de rupture, maximal au 3ème trimestre, directement proportionnel au diamètre de l'aorte. Risque de dissection de 10% si le diamètre est > 4.0 cm (Marfan) ou > 4.5 cm (bicuspidie). Dans ces cas:
- Remplacement de l'aorte ascendante en CEC avant une grossesse
- Dilatation en cours de grossesse: césarienne si le fœtus est viable puis opération de l'aorte
Coarctation de l'aorte: gradient de pression entre la crosse et l'aorte descendante, avec limitation du débit cardiaque dans la partie inférieure du corps. Risque d'hypertension en amont et d'hypotension en aval. La tachycardie permet d'augmenter le débit à travers la coarctation.
- Maintenir les RAS pour assurer la perfusion utéro-placentaire
- Maintenir la tachycardie
- Cathéter fémoral
|
© CHASSOT PG, THORIN D, NEFF R, Octobre 2005, dernière mise à jour, Novembre 2019
Références
- BAUMGARTNER H, BONHOEFFER P, DE GROOT N, et al. ESC guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J 2010; 31:2915-57
- BÉDARD E, DIMOPOULOS K, GATZOULIS MA. Has there been any progress made on pregnancy outcomes among women with pulmonary arterial hypertension ? Eur Heart J 2009; 30:256-65
- BRICKNER E. Cardiovascular management in pregnancy: congenital heart disease. Circulation 2014; 130:273-82
- DRENTHEN W, PIEPER PG, ROOS-HESSELINK JW, et al. Outcome of pregnancy in women with congenital heart disease: a literature review. J Am Coll Cardiol 2007; 49:2303-11
- ELKAYAM U, GOLAND S, PIEPER PG, SILVERSIDES CK. High-risk cardiac disease in pregnancy. Part II. J Am Coll Cardiol 2016; 68:502-16
- FERNANDES SM, ARENDT KW, LANDZBERG MJ, et al. Pregnant women with congenital heart disease: cardiac, anesthetic and obstetrical implications. Expert Rev Cardiovasc Ther 2010; 8:439-48
- FISCHER LG, VAN AH, BURKLE H. Management of pulmonary hypertension: physiological and pharmacological considerations for anesthesiologists. Anesth Analg 2003; 96:1603-16
- GOLAND S, BARAKAT M, KHATRI N, et al. Pregnancy in Marfan syndrome: maternal and fetal risk and recommendations for patient assessment and management. Cardiol Rev 2009; 17:253-62
- GOMAR C, ERRANDO CL. Neuroaxial anaesthesia in obstetrical patients with cardiac disease. Curr Opin Anaesthesiol 2005; 18:507-12
- HEMMES AR, KIELY DG, COCKRILL BA, et al. Statement on pregnancy in pulmonary hypertension from the Pulmonary Vascular Research Institute. Pulm Circ 2015; 5:435-65
- HO NC, TRAN JR, BEKTAS A. Marfan's syndrome. Lancet 2005; 366:1978-81
- JOHNSTON C, SCHROEDER F, FLETCHER SN, et al. Type A aortic dissection in pregnancy. Int J Obstet Anesth 2012; 21:75-97
- KHAIRY P, FERNANDES SM, MAYER JE, et al. Long-term survival, modes of death, and predictors of mortality in patients with Fontan surgery. Circulation 2008; 117:85-92
- KOWALIK E, KLISIEWICZ A, BIERNACKA EK, et al. Pregnancy and long-term cardiovascular outcome in women with congenitally corrected transposition of the great arteries. Int J Gynaecol Obstet 2014; 125:154-7
- MAITRA G, SENGUPTA S, RUDRA A; et al. Pregnancy and non-valvular heart disease – Anaesthetic considerations. Ann Card Anaesth 2010; 13: 102-9
- MARTIN JT, TAUTZ TJ, ANTONINI JF. Safety of regional anesthesia in Eisenmenger's syndrome. Reg Anesth Pain Med 2002; 27:509-13
- NIENABER CA, FATTORI R, MEHTA RH, et al. Gender-related differences in acute aortic dissection. Circulation 2004; 109:3014-21
- OSIBAMIRO-SEDUN A, JOHNSON C. Cardiac considerations for the obstetric patient. Sem Cardiothorac Vasc Anesth 2003; 7:167-73
- PIEPER PG, LAMEIJER H, HOENDERMIS ES. Pregnancy and pulmonary hypertension. Best Pract Res Clin Obstet Gynaecol 2014; 28:579-91
- PRESBITERO P, SOMERVILLE J, STONE S, et al. Pregnancy in cyanotic congenital heart disease. Outcome of mother and fetus. Circulation 1994; 89:2673-6
- RAY P, MURPHY GJ, SHUTT LE. Recognition and management of maternal cardiac disease in pregnancy. Br J Anaesth 2004; 93:428-39
- REGITZ-ZAGROSEK V, LUNDQVIST CB, BORGHI C, et al. 1018 ESC Guidelines on the management of cardiovascular diseases during pregnancy. Eur Heart J 2018; 39:3165-241
- REX S, DEVROE S. Anesthesia for pregnant women with pulmonary hypertension. Curr Opin Anaesthesiol 2016; 29:273-81
- ROOS.HESSELINK JW, RUYS TP, STEIN JI, et al. Outcome of pregnancy in patients with structural or ischaemic heart disease: results of a registry of the European Society of Cardiology. Eur Heart J 2013; 34:657-65
- WEISS BM, VON SEGESSER LK, ALON E, et al. Outcome of cardiovascular surgery and pregnancy: a systematic review of the period 1984-1996. Am J Obstet Gynecol. 1998; 179:1643-53





























