Step 5 of 7
Relaxation diastolique
Les fibres sous-épicardiques, qui se sont distendues pendant la contraction isovolumétrique et qui se sont contractées tardivement (80-100 msec après les couches profondes), prolongent leur contraction pendant le début de la diastole [7]. Cette contraction postsystolique est bien visible au Doppler tissulaire (Figure 5.29) ; son importance est proportionnelle à l’effet Starling subi par les fibres pendant la phase isovolumétrique, donc à la contractilité globale du VG. D’autre part, ces fibres sous-épicardiques se relâchent en commençant à la base pour finir à l’apex, contrairement aux couches sous-endocardiques et circulaires qui se relâchent comme elles se sont contractées, c’est-à-dire de l’apex vers la base. La relaxation sous-épicardique a donc lieu en dernier à l’apex [6].
Figure 5.29 : Déformation de la musculature sous-épicardique (courbe rouge) par rapport à la déformation moyenne (courbe bleue) de la paroi antérieure du VG. Les fibres sous-épicardiques, qui se sont distendues pendant la contraction isovolumétrique (CI) et qui se sont contractées tardivement (80-100 msec après les couches profondes), prolongent leur contraction pendant le début de la diastole. Cette contraction postsystolique est bien visible au Doppler tissulaire ; son importance est proportionnelle à l’effet Starling subi par les fibres pendant la phase isovolumétrique, donc à la contractilité globale du VG [6]. S : systole. RI : relaxation isovolumétrique. R : remplissage diastolique. CA : contraction auriculaire.
Pendant l’éjection, les fibres sous-épicardiques, plus longues et plus obliques que les fibres sous-endocardiques, ont pris une configuration en "S" forcée. En protodiastole, leur contraction persistante alors que tout le reste du VG s’est relâché va détordre le ventricule et l’allonger, de manière analogue à celle de la musculature paravertébrale d’un serpent lorsqu’il se dresse sur ses anneaux (Figure 5.30) [1,11]. Le fait que leur contraction se prolonge à l'apex (relaxation de la base vers l'apex) permet un remplissage optimal du VG jusqu'à sa pointe.
Figure 5.30 : Pendant l’éjection, les fibres sous-épicardiques, plus longues et plus obliques que les fibres sous-endocardiques, ont pris une configuration en "S" forcée. En protodiastole, leur contraction persistante alors que tout le reste du VG s’est relâché va détordre le ventricule et l’allonger, de manière analogue à celle de la musculature paravertébrale d’un serpent lorsqu’il se dresse sur ses anneaux [1,10].
La contraction sous-épicardique se poursuit jusqu’au nadir de la pression intraventriculaire, synchrone avec le pic de vélocité du flux mitral protodiastolique (flux E). Elle est visible sur un tracé du mouvement de l’anneau mitral en mode Doppler tissulaire sous forme d’un pic de raccourcissement pendant la phase de relaxation isovolumétrique (voir Figure 5.24) [9]. Ce phénomène correspond à la phase de relaxation protodiastolique dite "active", parce qu’elle consomme 15% de la mVO2 [2,6]. Comme l’avaient déjà exprimé de nombreux physiologistes, la protodiastole est une phase qui devrait être considérée comme partie intégrante de la systole, puisqu’elle consomme de l’O2, qu'elle répond de la même manière aux stimuli physiologiques (effet Starling, inotropisme, etc) et qu'elle est altérée très précocement dans l'ischémie myocardique. Il s’agit en fait d’un phénomène de systolic ventricular filling.
En protodiastole, la pression intraventriculaire baisse en dessous de la pression intra-thoracique (Figure 5.31). Cet effet de succion (relaxation active) est lié à deux phénomènes distincts [3,9] :
- La contraction post-systolique des fibres sous-épicardiques ; les β-stimulants ont un effet accélérateur sur la chute de pression (- dP/dt) ; le fait que cette contraction se termine à l’apex assure un meilleur remplissage puisque l’aspiration du sang est plus longue dans la partie apicale du VG.
- Le ressort élastique de la connectine, qui restitue en se déployant l’énergie emmagasinée pendant sa compression en systole ; la connectine, squelette interne de la myofibrille, est une macroprotéine fixée aux disques Z qui traverse toute la chaîne de myosine. La matrice de collagène ne participe pas au retour élastique en protodiastole mais limite l’expansion du volume en télédiastole.
Figure 5.31 : Remplissage diastolique du VG. En protodiastole, le VG fonctionne comme une pompe aspirante grâce à la contraction sous-épicardique résiduelle et à l’elasticité de la connectine (voir Figure 5.13) ; la pression intraventriculaire descend en dessous de la pression intrathoracique. Ce phénomène crée un fort gradient de pression entre l’OG et le VG (surface jaune), qui assure > 75% du remplissage pendant le flux mitral E. La contraction auriculaire (surface verte, flux A) complète le remplissage et fournit l’élévation de la pression télédiastolique.
De plus, l’anneau mitral, qui est descendu vers l’apex pendant la contraction longitudinale, remonte jusqu’à sa position télédiastolique en 2 étapes, pendant la phase de relaxation protodiastolique (relâchement des fibres sous-endocardiques et contraction sous-épicardique post-systolique) et pendant la phase de contraction auriculaire (traction par les fibres musculaires de l’oreillette). L’anneau mitral coulisse ainsi autour du volume de sang qui est au niveau de la valve et qui se retrouve passer de l’OG dans le VG sans même s'être déplacé (Figure 5.32).
Figure 5.32 : Coulissage de l’anneau mitral autour du volume de sang qui est au niveau de la valve et qui se retrouve passer de l’OG dans le VG sans même avoir à se déplacer. L’anneau mitral, qui est descendu vers l’apex pendant la contraction longitudinale, remonte jusqu’à sa position télédiastolique en 2 étapes, pendant la phase de relaxation protodiastolique (relâchement des fibres sous-endocardiques et contraction sous-épicardique post-systolique) et pendant la phase de contraction auriculaire (traction par les fibres musculaires de l’oreillette).
Il existe donc 3 phénomènes distincts pour expliquer le remplissage ventriculaire en début de diastole : la contraction de la musculature sous-épicardique, le ressort élastique de la connectine et le coulissage de l’anneau mitral. Comme ils dépendent des mêmes stimuli que la contraction systolique, ces trois phénomènes permettent d’accélérer le remplissage du VG à l’effort sans augmentation de la pression auriculaire gauche. En effet, cette dernière ne s’élève qu’à l’effort extrême ou dans des conditions pathologiques (dysfonction diastolique, hypervolémie, etc).
En diastole, le flux mitral fait un large vortex antérieur dans la région apicale, de manière à amener le sang en regard de la chambre de chasse et en avant du feuillet mitral antérieur ; dès que la pression monte en systole, cette masse de sang est éjectée en direction de la valve aortique et repousse le feuillet mitral en arrière jusqu’à l’occlusion (Vidéo) [4].
Vidéo: vue IRM du coeur gauche (OG, VG et aorte), correspondant à une vue parasternale long-axe en échocardiographie transthoracique; en diastole, on voit le flux tournoyer dans le sens horaire au sein du VG pour se placer sous la chambre de chasse.
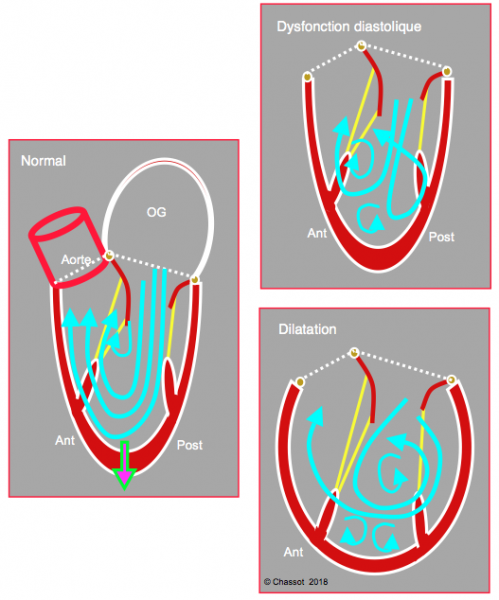
En mésosystole, le flux sanguin tournoie dans la cavité ventriculaire de manière à conserver son énergie cinétique (voir Figure 5.27C) [8]. Dans un tel système, le flux est continu, laminaire et ininterrompu ; la poussée hydrodynamique est longitudinale, allant de la mitrale vers l’apex et de l’apex vers la chambre de chasse. La perte d’énergie est minimale, le risque de thrombose est nul. Dans le cas d’un remodelage de la cavité ventriculaire à cause d’une cardiomyopathie, d’une dyskinésie ou d’une dilatation, le flux diastolique forme des vortex dispersés dans la cavité ventriculaire. Au lieu d’être strictement longitudinale, la poussée a des composantes transversales ou circulaires qui se croisent ; le désordre et l’instabilité de cette situation entraîne un gaspillage d’énergie, et le risque de stagnation locale augmente celui de thrombose (Figure 5.33) [5]. La présence de vortex anormaux à l’IRM cardiaque à contraste de phase est un signe avant-coureur de la cardiopathie structurelle [5].
Vidéo: vue IRM du coeur gauche (OG, VG et aorte), correspondant à une vue parasternale long-axe en échocardiographie transthoracique; en diastole, on voit le flux tournoyer dans le sens horaire au sein du VG pour se placer sous la chambre de chasse.
En mésosystole, le flux sanguin tournoie dans la cavité ventriculaire de manière à conserver son énergie cinétique (voir Figure 5.27C) [8]. Dans un tel système, le flux est continu, laminaire et ininterrompu ; la poussée hydrodynamique est longitudinale, allant de la mitrale vers l’apex et de l’apex vers la chambre de chasse. La perte d’énergie est minimale, le risque de thrombose est nul. Dans le cas d’un remodelage de la cavité ventriculaire à cause d’une cardiomyopathie, d’une dyskinésie ou d’une dilatation, le flux diastolique forme des vortex dispersés dans la cavité ventriculaire. Au lieu d’être strictement longitudinale, la poussée a des composantes transversales ou circulaires qui se croisent ; le désordre et l’instabilité de cette situation entraîne un gaspillage d’énergie, et le risque de stagnation locale augmente celui de thrombose (Figure 5.33) [5]. La présence de vortex anormaux à l’IRM cardiaque à contraste de phase est un signe avant-coureur de la cardiopathie structurelle [5].
Figure 5.33 : Flux diastoliques intraventriculaires. En situation normale, le flux mitral est dirigé légèrement postérieurement de manière à tournoyer à l’apex et à remonter vers la chambre de chasse ; le flux est continu et régulier, la perte d’énergie est minimale. En cas de dysfonction diastolique (ischémie myocardique, hypertrophie ventriculaire), la direction du flux mitral n’est plus homogène, il se crée des vortex irréguliers, et certaines composantes sont amenées à se croiser, ce qui représente une perte d’énergie hydraulique. Lors de dilatation ventriculaire, les flux sont chaotiques, la perte d’énergie est considérable et le risque de thrombose devient élevé [5].
| Relaxation diastolique |
|
La protodiastole est caractérisée par un effet de succion intraventriculaire (la pression du VG est inférieure à la pression thoracique): le VG fonctionne comme une pompe aspirante. Ceci est lié à 3 phénomènes:
- Persistance de la contraction sous-épicardique alors que les couches sous-endocardiques et circulaires se sont relâchées;
cette contraction détord et allonge le VG comme sa musculature paravertébrale redresse le serpent - Déploiement élastique de la connectine
- Coulissage de l'anneau mitral autour du volume de sang situé au niveau de la valve
Ces phénomènes dépendent des mêmes stimuli que la contraction systolique et permettent d'accélérer le remplissage à l'effort sans augmentation de la POG.
Depuis la valve mitrale, le flux diastolique décrit un large vortex antérieur au niveau de l'apex et vient se placer sous la CCVG; ce tournoiement continu permet de conserver l'énergie cinétique et de limiter le risque de thrombose.
|
© CHASSOT PG Août 2010, dernière mise à jour Novembre 2018
Références
- BUCKBERG GD, CASTELLA M, GHARIB M, SALEH S. Structure/function interface with sequential shortening of basal and apical components of myocardial band. Eur J Cardiothor Surg 2006; 29S:S75-S97
- DEL MONTE F, et al. Improvement in survival and cardiac metabolism after gene transfer of sarcoplasmic reticulum Ca++-ATPase in a rat model of heart failure. Circulation 2001; 104:1424-9
- GRANZIER HL, LABEIT S. The giant protein titin: a major player in myocardial mechanics, signaling and disease. Circ Res 2004; 94:284-95
- HYMEL BJ, TOWNSLEY MM. Echocardiographic assessment of systolic anterior motion of the mitral valve. Anesth Analg 2014; 118:1197-201
- PEDRIZZETTI G, LA CANNA G, ALFIERI O, TONTI G. The vortex – an early predictor of cardiovascular outcome ? Nat Rev Cardiol 2014; 11:545-53
- SENGUPTA PP, KORINEK J, BELOHLAVEK M, et al. Left ventricular structure and function. Basic science for cardiac imaging. J Am Coll Cardiol 2006; 48:1988-2001
- SENGUPTA PP, KRISHNAMOORTHY VK, KORINEK J, et al. Left ventricular form and function revisited: Applied translational science to cardiovascular ultrasound imaging. J Am Soc Echocardiogr 2007; 20:539-51
- SENGUPTA PP, PEDRIZZETTI G, KILNER PJ, et al. Emerging trends in CV flow visualization. JACC Cardiovasc Imag 2012; 5:305-16
- SENGUPTA PP, TAJIK AJ, CHANDRASEKARAN K, KHANDHEIRIA BK. Twist mechanics of the left ventricle. Principles and application. J Am Coll Cardiol Img 2008; 1:366-76
- TORRENT-GUASP F, BALLESTER M, BUCKBERG GD, et al. Spatial orientation of the ventricular muscle band: Physiologic contribution and surgical implications. J Thorac Cardiovasc Surg 2001; 122:389-92
- TORRENT-GUASP F, KOCICA MJ, CORNO A, et al. Systolic ventricular filling. Eur J Cardiothor Surg 2004; 25:376-86
05 Physiopathologie cardio-vasculaire
- 5.1 Préambule
- 5.2 Couplage de l'excitation et de la contraction myocardiques
- 5.3 La contraction myocardique
- 5.4 Mécanique ventriculaire
- 5.5 Physiopathologie de la systole
- 5.6 Physiopathologie de la diastole
- 5.7 Remplissage veineux
- 5.8 Interactions cardio-respiratoires
- 5.9 Dysfonction ventriculaire gauche
- 5.10 Fonction ventriculaire droite et circulation pulmonaire
- 5.11 Perfusion coronarienne et ischémie myocardique
- 5.12 Conclusions





























