Step 5 of 6
Aide technique
L’ETO offre une aide technique en visualisant la position des mandrins, des cathéters ou des canules lors de leur insertion. Lorsque l’on recherche un guide ou une canule, il est préférable de choisir une vue perpendiculaire à l’objet, car on le verra traverser le plan si le vaisseau est en court axe ; en long axe, il se peut que le cathéter soit en avant ou en arrière du plan, et de ce fait invisible à cause de la vue tangentielle.
- Pose de voie centrale : le mandrin apparaît dans l’OD (voir Figure 25.234) (Vidéo) ; s’il est invisible, le rechercher dans l’aorte ascendante et descendante. L’ETO est la technique la plus simple et la plus efficace pour vérifier la localisation et la position d’un cathéter.
Vidéo: vue mi-oesophagienne 0° centrée sur l'OD, avec le mandrin de la voie centrale en place au milieu de l'oreillette; le mandrin donne ici une image double car le plan ETO le coupe dans sa partie distale en "J".
- Pose de cathéter pulmonaire: une fois passée la valve tricuspide, l'ETO permet d'orienter le cathéter dans le VD en direction de la chambre de chasse (vue admission-chasse 60° ou vue bicave modifiée 90°), puis dans l'artère pulmonaire droite (vue court-axe de l'aorte ascendante 0°) [4].
- Canulation fémorale : une longue canule veineuse peut être guidée depuis la veine fémorale jusque dans l’OD ; vérifier que le mandrin ne la dirige pas dans l’OG par un FOP mais vers la VCS en vue bicave 100° (voir Figure 25.235).
- Guidage du cathéter de cardioplégie rétrograde dans le sinus coronaire : le sinus coronaire est bien visible en vue 4 cavités profonde et en vue bicave profonde avec léger pivotement anti-horaire de la sonde; sa lumière n’est plus identifiable lorsque la canule est en place.
- Endoprothèse aortique : contrôle du passage du guide dans la vraie lumière en cas de dissection aortique ; contrôle de la position de l’endoprothèse par rapport à un anévrysme, une déchirure intimale, ou la sous-clavière gauche (Figure 25.239).
- Contre-pulsion intra-aortique : contrôle de l’absence d’IA significative et de l’absence d’athérome mobile dans l’aorte descendante (Vidéo); l’extrémité du cathéter doit se trouver 1-3 cm distalemment par rapport à la sous-clavière gauche.
Vidéo: athérome protrudant dans la lumière de l'aorte thoracique descendante; il est situé au niveau d'un éventuel ballon de contrapulsion.
Vidéo: athérome mobile de l'aorte thoracique descendante; cette lésion est très emboligène.
- Canule d’assistance ventriculaire : positionnement de la canule dans l’OD ou dans le VG (apex), anastomose à l’aorte ascendante ou à l’artère pulmonaire, flux éjectionnel (voir Figure 25.230) ; positionnement trans-aortique (Impella™) ; vérifier le degré de décharge des cavités cardiaques, la fermeture et l’étanchéité de la valve aortique, et l’éventuelle dysfonction droite aiguë en cas d’asssistance monoventriculaire gauche [3].
- Valve aortique implantée : vérification de l’anatomie de la sténose aortique, positionnement du guide transapical dans l’aorte ascendante, position de la prothèse à cheval sur l’anneau aortique ; vérification du gradient, de l’étanchéité en diastole et du flux dans les coronaires (voir Chapitre 27, Endoprothèses valvulaires).
- Plastie mitrale percutanée : guidage et positionnement du clip, contrôle immédiat de la réduction de l’IM (voir Chapitre 27, Plastie mitrale percutanée).
- Chirurgie minimalement invasive et robotique : positionnement de la canule veineuse dans l’OD-VCS, contrôle de l’aorte thoracique avant canulation, mise en place du cathéter de vidange pulmonaire, contrôle permanent de la position du ballon de clampage aortique, surveillance du VG (risque de dilatation) et de la cardioplégie (voir Chapitre 10 et Chapitre 11 Invasivité minimale).
Figure 25.239 : Endoprothèse de l'aorte thoracique descendante. A: vue court-axe dun anévrysme de l'aorte descendante avec une endoprothèse en place. B: endoprothèse mal expandue; au vu de cette image, il faut ré-expandre l’endoprothèse au moyen d’un ballon. C: flux normal dans une endoptothèse située à l'intérieur d'un gros anévrysme thrombosé. D: fuite entre la prothèse et la paroi.
Examen tridimensionnel (3D)
L'examen tridimensionnel est particulièrement utile dans la chirurgie mitrale. Il offre une définition très supérieure des segments de la valve, des cordages et des dimensions de l’anneau (voir chapitre 26, Insuffisance mitrale, Imagerie 2D et 3D) [7]. La reconstruction 3D à partir de vues mi-oesophagiennes permet de voir la valve en face comme l’aperçoit le chirurgien depuis l’OG et de la couper selon différents plans. Grâce à des algorithmes adaptés, on peut faire des reconstructions paramétriques pour mesurer directement la surface de l'orifice de régurgitation, la surface des feuillets, le volume des prolapsus, la distance intercommissurale, le volume de tente, la non-planarité de l'anneau, la quantification volumétrique du jet d'IM, la planimétrie de la vena contracta, etc (Vidéos). On peut ainsi y faire une série de mesures [9,11].
Vidéo: la reconstruction 3D offre une image de la valve mitrale depuis l'OG identique à celle du chirurgien dans le champ opératoire.
Vidéo: vue d'un prolapsus de la partie antéro-médiane du feuillet postérieur avec une rupture de cordage.
- Diamètre antéro-postérieur de l'anneau: normal < 1.6 cm/m2 (Barlow: > 2.5 cm/m2);
- Surface de l'anneau: normal < 5 cm2/m2 (Barlow: > 7.5 cm2/m2);
- Surface du feuillet antérieur: normal < 2.75 cm2/m2 (Barlow: > 4.75 cm2/m2);
- Diamètre intercommissural: normal < 1.8 cm/m2, sans modification au cours de la systole (Barlow > 1.8 cm/m2, avec élargissement en télésystole);
- Elévation de l'anneau mitral (hauteur de selle): normal 1 cm (Barlow < 0.8 cm);
- Hauteur de ballonnisation: dégénérescence fibro-élastique < 1 cm, Barlow > 1 cm;
- Volume de ballonnisation: dégénérescence fibro-élastique < 1.15 cm3 , Barlow > 1.15 cm3;
- Volume de tente (IM secondaire sévère: > 1.5 cm3).
L’évaluation de la taille optimale de l’anneau prothétique lors de valvuloplastie est bien corrélée à celle de l’anneau réellement implanté grâce à une technique de superposition d’un modèle informatique de l’anneau sur l’image de la reconstruction 3D [5]. Comme il illustre la valve mitrale entourée des structures avoisinantes, le 3D permet une meilleure interprétation des interférences entre la chambre d’admission et de la chambre de chasse du VG (risque de SAM) (Vidéo). Après correction, l'éventuel orifice de régurgitation résiduelle est bien mesurable; l’origine des fuites paravalvulaires ou para-annulaires est particulièrement bien localisable et quantifiable (Figure 25.240) [6].
Vidéo: vue depuis le VG de la chambre d'admission avec la valve mitrale (en-bas à l'écran) et de la chambre de chasse avec la valve aortique. En diastole, le feuillet antérieur flotte librement entre les deux chambres; sa proximité avec la CCVG le rend susceptible d'y être aspiré en systole lorsqu'il est trop long ou lorsque la cavité ventriculaire devient trop petite.
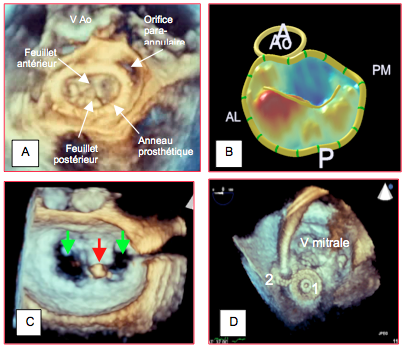
Figure 25.240 : Illustrations de l’apport de la technologie tridimensionnelle en chirurgie cardiaque et en cardiologie invasive. A : vue depuis l’oreillette gauche d’une valve mitrale ayant subi une plastie avec insertion d’un anneau prothétique ; il existe un orifice para-annulaire occasionnant une fuite mitrale importante. B : reconstruction paramétrique de l’anneau mitral lors d’un prolapsus de P1 ; la partie qui prolabe dans l’OG (au dessus du plan de l’anneau) est coloriée en rouge ; la partie du feuillet antérieur qui est en-dessous de l’anneau (côté ventriculaire) apparaît en bleu. C : plastie mitrale selon Alfieri par un clip mitral introduit par voie percutanée ; les feuillets mitraux sont fixés l’un à l’autre par leur extrémité distale (A2 et P2) (flèche rouge) ; en diastole, la valve mitrale présente une double ouverture (flèches vertes). D : pose de 2 dispositifs d’occlusion (1 et 2) pour fermer une fuite paravalvulaire mitrale.
Comparé à l’imagerie bidimensionnelle, l’écho 3D permet une nette amélioration des performances diagnostiques dans plusieurs autres domaines directement liés à la chirurgie cardiaque [1,8,12].
Vidéo: vue depuis le VG de la chambre d'admission avec la valve mitrale (en-bas à l'écran) et de la chambre de chasse avec la valve aortique. En diastole, le feuillet antérieur flotte librement entre les deux chambres; sa proximité avec la CCVG le rend susceptible d'y être aspiré en systole lorsqu'il est trop long ou lorsque la cavité ventriculaire devient trop petite.
Figure 25.240 : Illustrations de l’apport de la technologie tridimensionnelle en chirurgie cardiaque et en cardiologie invasive. A : vue depuis l’oreillette gauche d’une valve mitrale ayant subi une plastie avec insertion d’un anneau prothétique ; il existe un orifice para-annulaire occasionnant une fuite mitrale importante. B : reconstruction paramétrique de l’anneau mitral lors d’un prolapsus de P1 ; la partie qui prolabe dans l’OG (au dessus du plan de l’anneau) est coloriée en rouge ; la partie du feuillet antérieur qui est en-dessous de l’anneau (côté ventriculaire) apparaît en bleu. C : plastie mitrale selon Alfieri par un clip mitral introduit par voie percutanée ; les feuillets mitraux sont fixés l’un à l’autre par leur extrémité distale (A2 et P2) (flèche rouge) ; en diastole, la valve mitrale présente une double ouverture (flèches vertes). D : pose de 2 dispositifs d’occlusion (1 et 2) pour fermer une fuite paravalvulaire mitrale.
Comparé à l’imagerie bidimensionnelle, l’écho 3D permet une nette amélioration des performances diagnostiques dans plusieurs autres domaines directement liés à la chirurgie cardiaque [1,8,12].
- La quantification de la masse et du volume ventriculaires gauches, le calcul de la fraction d'éjection volumétrique (Vidéo).
- L'évaluation de la géométrie complexe du VD, le calcul de son volume et de sa fraction d'éjection.
- L’imagerie de la valve aortique et de la chambre de chasse gauche les montre en relation avec les coronaires, le septum et le feuillet antérieur de la mitrale, ce qui est précieux pour le placement des endoprothèses aortiques ou la stratégie chirurgicale dans les plasties et les endocardites.
- La vision "en face" du septum interauriculaire permet une bien meilleure évaluation des CIA et des FOP, et un placement plus rigoureux des dispositifs d’occlusion [10].
- Le fonctionnement des prothèses valvulaires, la présence et la localisation précise des déhiscences, des fuites paravalvulaires et des lésions endocarditiques (Vidéo).
Vidéo: reconstruction 3D d'un moulage de l'endocarde du VG permettant de suivre son volume en continu au cours du cycle cardiaque; l'évolution celui-ci est illustrée par la courbe jaune au bas de l'écran.
Vidéo: vue depuis l'OG d'un anneau prosthétique après plastie mitrale. Un orifice para-annulaire est visible à 2 heures, occasionnant une fuite mitrale importante. La localisation de cet orifice est grandement facilitée par le 3D.
- L'évaluation pré- et post-CEC de plastie ou de correction de cardiopathie congénitale complexe.
- Le 3D, particulièrement dans le mode XPlane qui visualise simultanément 2 plans orthogonaux, est une aide précieuse pour le positionnement des dispositifs non-invasifs de remplacement valvulaire aortique, d’occlusion de CIA ou d’appendice auriculaire gauche, et de clipage de la valve mitrale (Vidéos) [2].
Vidéo: vues orthogonales simultanées (X-Plane) d'une sténose aortique, avec l'image en long-axe à gauche et en court-axe à droite.
Vidéo: vue 3D depuis l'OG d'un MitraClip en place fixant la partie médiane des deux feuillets.
Comme la technologie tridimensionnelle se popularise de plus en plus, ces prochaines années verront surgir de nouvelles applications en chirurgie cardiaque et son installation dans la routine de l’examen standard.
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
| Aide technique de l'ETO |
| L'ETO est une aide pour visualiser du matériel endovasculaire dans de nombreuses situations peropératoires: - Pose de voie centrale - Canulations de CEC - Contre-pulsion intra-aortique - Canulation d'assistance ventriculaire - Endoprothèses aortiques - Endoprothèses valvulaires - Chirurgie minimalement invasive En visualisant les éléments dans l'espace, l'examen tri-dimensionnel est une aide supplémentaire dans plusieurs circonstances. - Valve mitrale: diagnostic des lésions des feuillets, mesure des sténoses, reconstruction paramétrique de l'anneau, dimensions de la vena contracta (IM) - Valve aortique: planimétrie, structure des cuspides - CCVG: mesure des diamètres (section elliptique) - Ventricule gauche: mesure et suivi précis des volumes et de la fraction d'éjection - Ventricule droit: mesure cohérente du volume et de la fraction d'éjection - Diagnostic des masses et thrombus - Précision sur l'anatomie des cardiopathies congénitales - Aide lors de manœuvres semi-invasives (TAVI, MitraClip, Amplatzer) |
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
- BADANO LP, LANG RM, GONCALVES A. Three-dimensional echocardiography. In: LANCELOTTI P, ZAMORANO JL, HABIB G, BADANO L. The EACVI Textbook of echocardiography. Oxford: Oxford University Press, 2017, 59-69
- BALZER J, KUHL H, RASSAF T, et al. Real-time transesophageal three-dimensional echocardiography for guidance of percutaneous cardiac interventions: first experience. Clin Res Cardiol 2008; 97: 565-74
- CATENA E, MILAZZO F. Echocardiography and cardiac assist devices. Minerva Cardioangiol 2007; 55:247-65
- CRONIN B, KOLOTINIUK N, YOUSSEFZADEH K, et al. Pulmonary artery catheter placmenet aided by transesophageal echocardiography versus pressure waveform transduction. J Cardiothorac Vasc Anesth 2018; 32: 2578-82
- ENDER J, EIBEL S, MUKHERJEE C, et al. Prediction of the annuloplasty ring size in patients undergoing mitral valve repair using real-time three-dimensional transoesophageal echocardiography. Eur J Echocardiogr 2011 ; 12 :445-53
- FRANCO E, ALMERIA C, DE AUGUSTIN JA, et al. Three-dimensional color Doppler transesophageal echocardiography for mitral paravalvular leak quantification and evaluation of percutaneous closing success. J Am Soc Echocardiogr 2014; 27:1153-63
- GREWAL J, MANKAD S, FREEMAN WK. Real-time three-dimensional transesophageal echocardiography in the intraoperative assessment of mitral valve disease. J Am Soc Echocardiogr 2009; 22:34-41
- MAHMOOD F, JEGANATHAN J, SARAF R, et al. A practical approach to an intraoperative three-dimensional transesophageal echocardiography examination. J Cardiothorac Vasc Anesth 2016; 30:470-90
- POELAERT JL, BOUCHEZ S. Perioperative echocardiographic assessment of mitral valve regurgitation: a comprehensive review. Eur J Cardio-Thorac Surg 2016; 50:801-12
- SKOLNICK A, VAVAS E, KRONZON J. Optimization of ASD assessment using real-time three-dimensional transesophageal echocardiography. Echocardiography 2009; 26:233-5
- SUGIMOTO T, DULGHERU R, MARCHETTA S, et al. What does 3D echocardiography ass to 2D echocardiography in the assessment of mitral regurgitation ? Curr Cardiol Rep 2017; 19:90
- VEGAS A, MEINERI M. Three-dimensional echocardiography is a major advance for intraoperative clinical management of patients undergoing cardiac surgery: A core review. Anesth Analg 2010; 110:1548-73
25. Echocardiographie transoesophagienne 1ère partie
- 25.1 Introduction
- 25.2 Principes physiques de l'échocardiographie
- 25.3 Anatomie fonctionnelle
- 25.3.1 Technique et risques de l'ETO
- 25.3.2 Examen standard 2D
- 25.3.3 Examen des valves
- 25.3.4 Examen bidimensionnel des ventricules
- 25.3.5 Examen des oreillettes
- 25.3.6 Mode TM
- 25.3.7 Examen Doppler
- 25.3.8 Examen tridimensionnel (3D)
- 25.3.9 Mesures quantitatives
- 25.3.10 Examen rapide
- 25.3.11 Images artéfactuelles
- 25.3.12 Rapport d'examen
- 25.4 Mesures hémodynamiques
- 25.5 Fonction systolique du VG
- 25.6 Fonction diastolique du VG
- 25.7 Fonction ventriculaire droite
- 25.8 Fonction ventriculaire segmentaire
- 25.9 Insuffisance cardiaque
- 25.10 Place de l'ETO en clinique
- 25.11 ETO en chirurgie cardiaque
- 25.12 ETO en chirurgie non-cardiaque
- 25.13 Echocardiographie en soins intensifs
- 25.14 Echocardiographie au déchocage
- 25.15 Echocardiographie transthoracique
- 25.16 Conclusions





























