Step 4 of 10
Echocardiographie de l'insuffisance mitrale
Le capteur ETO est idéalement placé à mi-œsophage pour observer la valve mitrale; seule l'OG, dont le sang conduit parfaitement les ultrasons, s'interpose entre le transducteur et la valve. La valeur prédictive positive de l’ETO concernant le mécanisme de l’IM est de 90-96%; elle monte à 98% avec l’imagerie 3D [18]. Avec le Doppler couleur, il est enfantin de diagnostiquer la présence d'une insuffisance mitrale, mais les deux points essentiels de l’examen sont plus délicats:
- Déterminer le mécanisme de l’IM;
- Quantifier le degré d’insuffisance en synthétisant une série d’éléments.
Pour rappel, l’insuffisance mitrale est divisée en deux catégories: IM primaire (lésion structurelle des feuillets, de l'anneau et de l'appareil sous-valvulaire) et IM secondaire (valve normale mais lésion/dysfonction ventriculaire gauche). Par ailleurs, l'IM est habituellement classée en trois types selon le déplacement du bord libre des feuillets par rapport au plan de l'anneau (classification de Carpentier) (voir Figure 11.67) [4].
- Type I: le mouvement des feuillets et leur structure sont normaux;
- Type II: le mouvement des feuillets est excessif (bascule dans l’OG);
- Type III: le mouvement des feuillets est restrictif:
- IIIa: restriction systolo-diastolique (feuillets rigides et peu mobiles);
- IIIb: restriction systolique seulement (rétention dans le VG en systole).
Les types II et IIIa sont des IM primaires structurelles, alors que les types I et IIIb correspondent à des IM secondaires fonctionnelles.
L'orientation de la valve mitrale est décalée d'environ 60° par rapport aux plans orthogonaux de l'organisme. Ses plans orthogonaux sont donc la vue bicommissurale à 40-60°, qui coupe les deux commissures, et la vue long-axe à 120-140°, qui lui est perpendiculaire (voir Figure 11.21). Le feuillet postérieur, en forme de croissant de lune, est anatomiquement divisé en 3 festons: P1 en avant, P2 au milieu et P3 en arrière. Le feuillet antérieur, plus quadrangulaire, est suvdivisé en A1, A2 et A3 par analogie, bien que cette notification ne corresponde à aucune entité anatomique. Comme repères échocardiographiques, la valve aortique jouxte la base du feuillet antérieur, et l'appendice auriculaire gauche est situé en regard de la commissure antérieure. Le point de coaptation de la valve est situé en-dessous du plan de l'anneau mitral; vu la forme en selle de ce dernier, la position du point de coaptation doit être évaluée en long-axe 120-140° et non en vue 4-cavités 0° (voir Figure 11.3).
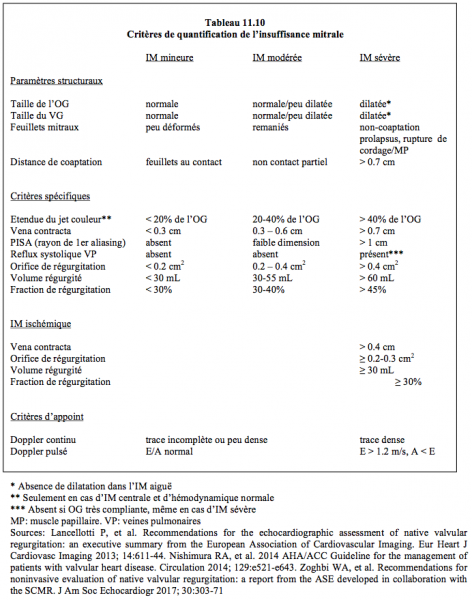
L’IM est habituellement quantifiée en trois degrés (mineure, modérée ou sévère) selon différents critères fondés sur l'imagerie bidimensionnelle, le Doppler spectral ou le Doppler couleur, et obtenus par calcul avec l'équation de Bernouilli ou l'équation de continuité (Tableau 11.10) (pour davantage de détails, voir Chapitre 26, Insuffisance mitrale). Chaque indice échocardiographique est intrinséquement limité dans sa portée et ne doit en aucun cas fonder à lui seul une indication opératoire. Celle-ci relève d'une intégration de l'ensemble des paramètres évalués.
Examen 2D
Les affections dégénératives sont la cause la plus fréquente d'IM primaire. Elles présentent plusieurs types de lésions (Figure 11.73A) [24].
- Anomalie morphologique: les feuillets sont épaissis, redondants, bosselés; leur longueur est excessive (dégénérescence myxoïde, maladie de Barlow).
- Ballonnisation: l'excès de tissu valvulaire donne une image de dôme bombant dans l'OG en systole, mais le point de coaptation est maintenu en-dessous du plan de l'anneau mitral.
- Bascule de feuillet (flail leaflet): l'éversion de l'extrémité d'un feuillet est en général liée à une élongation ou à une rupture de cordage.
- Prolapsus: le point de coaptation est situé > 2 mm en arrière du plan de l'anneau mitral, dans l'OG (mesuré en vue long-axe 120-140°). L'image 2D permet la mesure de la distance séparant les 2 feuillets en systole et celle de la largeur du dôme réalisé par le prolapsus.
- RAA: les commissures sont fusionnées, les feuillets sont fibrosés et rigides; l'IM est due à leur manque de mobilité qui les rend restrictifs en systole et en diastole; elle est souvent accompagnée d'une composante de sténose.
Figure 11.73A : Différentiation des lesions dégénératives. Dans le prolapsus; le point de coaptation est situé ≥ 2 mm en arrière du plan de l'anneau mitral, au sein de l'OG. Dans la ballonnisation; le point de coaptation est normalement situé mais l’excès de tissu valvulaire induit un bombement systolique du corps d’un feuillet. Lors de basculement, tout ou partie d’un feuillet est éversé dans l’OG, la plupart du temps avec une rupture de cordage(s). La dégénérescence est caractérisée par des feuillets remaniés, épaissis, bosselés, avec un excès de tissu (Barlow). L'image 2D permet de mesurer la distance séparant les feuillets en systole, qui représente l'importance de l'IM, et la largeur du prolapsus, en l'occurrence P2 en vue bicommissurale (60°).
Dans les IM secondaires, les feuillets sont normaux et la pathologie est située dans le ventricule gauche qui a subi un remodelage important. On rencontre essentiellement deux cas de figure: l'ischémie myocardique avec anomalies de la cinétique segmentaire et la dilatation ventriculaire. Une dilatation massive de l'OG entrainant une distension de l'anneau mitral est une troisième possibilité. L'image échocardiographique est caractéristique (Figure 11.73B).
- La dilatation de l'anneau (diamètre > 35 mm) empêche une coaptation normale et laisse un orifice persistant en systole.
- Les feuillets sont de morphologie normale, mais ils ne se rejoignent pas en systole; ils sont maintenus en-dessous du plan de l'anneau mitral par la traction excessive des cordages due à la dilatation ventriculaire (IM restrictive symétrique) ou à l'akinésie d'une paroi (IM restrictive asymétrique).
Figure 11.73B: Insuffisance mitrale restrictive sur dilatation et dysfonction du VG. Le point de coaptation des feuillets mitraux en systole est retenu en-dessous du plan de l'anneau mitral, occasionnant une fuite centrale dans l'OG.
La bascule d'un feuillet dans l'OG, la non-coaptation laissant un large orifice en systole et la rupture de cordages ou de muscle papillaire sont pathognomoniques d'une IM sévère. La reconstruction 3D avec, entre autre, la vue de la mitrale "en-face" depuis l'OG comme l'aperçoit le chirurgien permet d'affiner le diagnostic et de mesurer les structures avec davantage précision; en général, les vues 2D tendent à sous-estimer l'étendue du prolapsus en comparaison des mesures 3D, car le plan de coupe est relativement arbitraire par rapport aux dimensions maximales des lésions (Figure 11.74) [20].
Figure 11.74 : Imagerie tri-dimensionnelle de l’IM vue depuis l’OG. A : fente (cleft) dans le feuillet antérieur; cette pathologie peut être très difficile à mettre en évidence en 2D alors qu'elle est bien visible en 3D. B : Image d’un prolapsus mitral de P1 ; on voit un cordage rupturé à l’extrémité du prolapsus (flèche). C : Prolapsus du feuillet antérieur (flèche) observé en protosystole. D : prolapsus de la commissure postérieure.
Jet d'IM au Doppler couleur
L'étendue du jet couleur est un excellent moyen de détecter une IM et de se faire une idée de son importance, mais elle n'est nullement un moyen de quantifier l'importance de la régurgitation (Figure 11.75). Le jet d'IM que l'on voit à l'écran est une cartographie des vélocités, mais il ne représente nullement le volume régurgité. La classification en 4 degrés basés seulement sur l’étendue du jet tourbillonnaire dans l’OG n'est plus recommandée, car la dimension du jet dépend du réglage de l'échelle couleur et du gain des gris (gray scale), de l'angle du faisceau Doppler, de la vélocité des hématies, de la fonction ventriculaire, des conditions hémodynamiques et de la compliance de l'OG; d'autre part, elle est inversément proportionnelle à la dimension de l’orifice de régurgitation. Alors que la combinaison d'un bon VG et d'un petit orifice donne un jet de haute vélocité très brillant à l'écran, celle d'un VG défaillant et d'un large orifice genère au contraire un jet de basse vélocité peu tourbillonaire. Le volume régurgité effectif est surestimé dans le premier cas et sousestimé dans le second [5]. D'autre part, un jet central de haute vélocité tend à s'augmenter par effet aspiratif sur du sang déjà dans l'OG, alors qu'un jet excentrique se freine contre la paroi et diminue d'intensité. L'appréciation d'une IM doit se faire sur une période de rythme cardiaque régulier et de fréquence normale, en évitant le renforcement post-extrasystolique; en cas de FA, on moyenne plusieurs mesures réalisées dans une période de 2-4 cycles dont la fréquence voisine 60-80 batt/min. D'une manière générale, un jet central dans l'OG suggère la présence d'une IM fonctionnelle, alors qu'un jet oblique et excentrique traduit une IM organique liée à une pathologie des feuillets.
Figure 11.75 : Images ETO d’insuffisance mitrale au Doppler couleur. A : IM mineure. B : IM modérée. C : IM sévère centrale. D : IM sévère excentrique. L'étendue du jet couleur permet une bonne appréciation de l'importance de l'IM, mais elle n'autorise pas une réelle quantification.
Vena contracta
Lorsqu'il franchit un passage rétréci, le flux s'accélère de manière laminaire et se contracte. La contraction maximale a lieu quelques millimètres au-delà de l'orifice, à un endroit appelé en hydrodynamique vena contracta (Figure 11.76A). Comme le flux sanguin y est encore laminaire, la surface de section de cette zone reproduit fidèlement la forme de l'orifice, mais elle est légèrement plus petite que celle de l'orifice anatomique (GOA, geometrical orifice area). La mesure du diamètre de la vena contracta est une excellente technique pour évaluer la dimension de l’orifice effectif de régurgitation (EROA, effective regurgitant orifice area) (voir Echocardiographie Doppler). Il convient de moyenner 2-3 mesures effectuées dans deux plans orthogonaux pour obtenir une mesure cohérente. Les valeurs de diamètres sont : < 3 mm pour une IM mineure, 3-6 mm pour une IM modérée et ≥ 7 mm pour une IM primaire sévère [24,45]. La mesure est valable pour le jets centraux et pour les jets excentriques.
Cette manière de procéder suppose que l'orifice de régurgitation est de symétrie circulaire. C'est grossièrement le cas dans les IM primaires, mais non dans les IM secondaires, parce que la valve n'y est pas déformée: l'orifice de régurgitation a la forme en croissant de la commissure mitrale, et l'assimilation à un cercle devient erronée. A défaut de balayer systématiquement la commissure dans la vue bi-commissurale à 40-60°, l'observation de tous les plans de coupe sous-estime donc l'importance de l'orifice en cas d'IM secondaire. De ce fait, la définition retenue pour le diamètre de vena contracta d'une régurgitation sévère dans le cas d'une IM ischémique est une valeur > 4 mm [2,24,31,46]. Pour éviter des indications opératoires excessives, toutefois, les recommandations américaines sont revenues aux mêmes critères pour les IM secondaires que pour les IM primaires [32]. En présence de jets multiples, on ne peut pas additionner les différents diamètres pour obtenir une valeur totale. La reconstruction 3D du flux couleur permet de visualiser la section réelle de la vena contracta en opérant une découpe perpendiculaire au flux; la surface de la vena contracta est alors bien corrélée à celle de l'orifice de régurgitation, notamment dans l'IM secondaire [1,18].
Figure 11.76 : Vena contracta et zone de convergence de flux. A : schéma des signes échocardiographiques Doppler couleur d’une IM sévère : large zone d'accélération intraventriculaire (PISA : Proximal isovelocity surface area), vena contracta (zone de flux laminaire immédiatement distale à l’orifice de régurgitation) de > 0.7 cm de diamètre, et vaste zone tourbillonnaire intra-auriculaire. B: le PISA est bien visible sous forme d'hémisphères concentriques; sa dimension est une traduction directe de l’importance de l’IM. La flèche violette marque la surface de 1er aliasing (passage du jaune au bleu). La flèche blanche indique la vena contracta.
Zone de convergence du flux
La zone de convergence hémisphérique du flux correspond à la zone où les molécules de fluide doivent accélérer progressivement pour passer d’une cavité large à un orifice étroit. Cette zone est d’autant plus grande que la quantité de liquide qui doit transiter par l’orifice est importante. Cette zone est appelée proximal isovelocity surface area, ou PISA, parce que la vitesse du fluide est la même sur la toute la surface de chaque hémisphère concentrique successif (Figure 11.76B) [11]. Selon l’équation de continuité, le produit de la vélocité à la surface d’un hémisphère et de la surface de cet hémisphère est égal au produit de la vélocité maximale à travers l’orifice et de la surface de ce dernier, puisque tout le sang de l'hémisphère passe à travers l'orifice de régurgitation :
(S • V)hémisphère = (S • V)orifice
Il est facile de mesurer la surface de l’hémisphère concentrique en repérant la limite à laquelle a lieu l’inversion de couleur du flux. Cette inversion (aliasing) survient lorsque la Vmax du flux dépasse celle qui est lisible pour l’échelle de couleur choisie (limite de Nyquist). Le choix de celle-ci est capital: la Vmax lisible doit être de 20-40 cm/s. Le rayon de l'hémisphère de premier aliasing permet de calculer la surface de ce dernier (S = 2 π r2, soit 6.28 r2). Pour une insuffisance mitrale:
S orifice de régurgitation = (Shémisph • Valiasing) / VmaxIM
SOR = (6.28 r2 • Valiasing) / VmaxIM
La Vmax de l'IM doit être mesurée au même moment de la systole que la Vmax du premier aliasing. A partir de la surface de l'orifice de régurgitation, il est aisé d'obtenir le volume de régurgitation (Vrég) en multipliant celle-ci par l'intégrale des vélocités de l'IM (ITV):
Vrég (cm3) = SOR (cm2) • ITVIM (cm)
Pour mieux percevoir la signification de l'insuffisance, on peut rapporter le volume régurgité au volume télédiastolique du VG (Vrég/VtdVG); en effet, le même Vrég représente une fraction de régurgitation (Vrég/VS) très différente selon le degré de dilatation du VG [34]. La relation entre la surface et le volume de régurgitation n'est pas linéaire, parce que la première est évaluée à un instant précis de la systole alors que le second représente le volume écoulé pendant la durée totale de celle-ci. Or l'insuffisance mitrale n'est pas toujours holosystolique et présente en général une augmentation méso-télé-systolique en cas d'IM primaire [5].
La surface de l'orifice de régurgitation (SOR) est le paramètre le plus robuste pour définir la sévérité de l'IM [24]. Les valeurs admises sont les suivantes.
- IM mineure: < 0.2 cm2 (Vrég < 30 mL)
- IM modérée: 0.2-0.4 cm2 (Vrég 30-55 mL)
- IM sévère: > 0.4 cm2 (Vrég > 60 mL)
En clinique, on peut utiliser une simplification: si l’échelle de couleur est réglée sur une vélocité d’aliasing de 50 cm/s, un rayon de 1 cm pour l’hémisphère de 1er aliasing équivaut à un orifice de régurgitation > 0.5 cm2, ce qui correspond à une IM sévère [30]. Dans les IM secondaires, le seuil est plus bas car le PISA n'est pas hémisphérique ni ellipsoïde mais de volume variable en fonction de la forme de la commissure. La simple mesure du rayon de PISA sousestime l'importance de l'IM. Dans ce cas, l'IM est considérée comme sévère lorsque la SOR est > 0.2 cm2 et le Vrég > 30 mL. L'analyse du flux couleur en 3D montre que le PISA réel est plus grand que celui visualisé en vue 2D dans l'IM secondaire; il en est de même pour la surface de régurgitation calculée [1].
Malgré ses performances, le calcul du SOR et du Vrég dérivé du PISA dépend de la mesure unidimensionnelle d'un élément tridimensionnel, réalisée à un instant précis de la systole alors que le phénomène varie au cours de l'éjection (voir ci-dessous: IM primaire vs secondaire). On extrapole ainsi à toute la systole une image obtenue à un moment précis, ce qui peut conduire à une surestimation importante de l'IM; le mode TM couleur permet d'apprécier les variations d'intensité en cours d'éjection et de corriger l'erreur, au moins partiellement. Comme tout Doppler couleur, la mesure est influencée par l'échelle couleur (en l'occurrence 20-40 cm/s), l'échelle des gris (en l'occurance 50%) et l'angle entre le flux et l'axe d'analyse [8]. D'autres limitations sont encore à prendre en compte: faible précision dans les IM excentriques, difficulté à définir la localisation de l'orifice mitral au milieu du flux couleur, forme supposée circulaire de l'orifice, géométrie du PISA modifiée par les structures adjacentes, synchronisation supposée entre la Vmax de l'IM et la Vmax du PISA [5,16]. Outre l'automaticité des calculs, les nouvelles plateformes d'écho commencent à disposer d'algorithmes de reconnaissance de forme permettant de limiter les marges d'erreur et de variabilité dans les mesures.
Doppler spectral
L'examen du flux mitral antérograde au Doppler pulsé, avec le volume d'échantillonnage positionné entre les extrémités des feuillets où la vélocité du flux est la plus grande, montre un flux E dont la vélocité est ≥ 1.5 m/s. Cette accélération est due au grand volume qui passe par la mitrale en début de diastole, puisque le volume de remplissage normal d'un cycle cardiaque est augmenté du volume régurgité pendant la systole précédente. Le rapport entre l'intégrale des vélocité à travers la mitrale et à travers la valve aortique (VTIVM/VTIVAo) est > 1.4 dans les IM sévères. Ces remarques s'appliquent essentiellement à l'IM primaire; dans l'IM secondaire, il devient difficile de distinguer l'élévation de la Vmax du flux E due à l'insuffisance mitrale de celle liée à la dysfonction diastolique restrictive [5].
En plaçant le volume d'échantillonnage 1-2 cm à l'intérieur d'une veine pulmonaire (VP), on observe le flux continu biphasique typique des grandes veines centrales, accompagné d'un très léger reflux de courte durée au moment de la contraction auriculaire, dû à l'absence de valve entre l'OG et les VP. La composante systolique (S) du flux antérograde dépend de la pression dans l'OG, puisque la mitrale est fermée à ce moment. Si cette dernière fuit, la composante S est amortie; elle est inversée lorsque l'IM est sévère. Ce reflux systolique massif dans les VP est un excellent critère pour une IM sévère lorsqu'il est présent, mais son absence n'exclut nullement une IM majeure. En effet, ce reflux est dépendant de la compliance de l'OG (une oreillette très dilatée amortit le flux régurgité) et de la direction du jet (un jet excentrique peut refluer dans les VP d'un seul côté). Pour être significatif, le reflux systolique dans les VP doit être observé des deux côtés (voir Figure 26.35).
Figure 26.35 : Reflux systolique dans les veines pulmonaires. A : image spectrale au Doppler pulsé dans la veine pulmonaire supérieure gauche. B : les veines droites présentent moins d’angle que les veines gauches par rapport à l’axe d’une IM centrale symétrique. C : la composante systolique du flux veineux pulmonaire n’est pas modifiée par une trace d’IM, mais est diminuée dans une IM modérée, partiellement inversée dans une IM modérée-à-sévère et renversée dans une IM sévère ; ce reflux progressif n’existe pas si l’OG est dilatée et très compliante.
L'examen du flux de l'IM au Doppler continu montre une Vmax de 4-6 m/s et une trace d'autant plus dense que l'IM est plus importante. L'IM et la sténose aortique créent toutes deux des flux accélérés systoliques s'éloignant de l'apex. A l'examen transthoracique comme à l'examen transoesophagien, ces deux flux peuvent se confondre, mais leur morphologie les différencie. Le flux d'IM est arrondi, débute pendant la phase de contraction isovolumétrique et se termine pendant la phase de relaxation isovolumétrique, alors que le plus aortique a une forme plus triangulaire et une durée réduite à la phase d'éjection (Figure 11.77).
Figure 11.77 : Flux Doppler spectral en cas d'IM (Doppler continu). A: flux Doppler d'une IM modérée; la trace est peu dense et l'enveloppe incertaine. B: flux Doppler spectral; la Vmax est 5-6 m/s, la trace est compacte et l’enveloppe bien définie. C: le flux mitral démarre dès que la PVG dépasse 5-8 mmHg, bien avant l’ouverture de la valve aortique au moment de laquelle débute le flux systémique; il n’y a donc pas de vraie phase isovolumétrique. Le flux aortique est plus triangulaire et ne dure que la phase d'éjection.
Quantification de l'IM
Pour résumer, l’insuffisance mitrale sévère est caractérisée par les critères suivants (voir ci-dessus Tableau 11.10). [2,14,23,24,31,32].
- Dilatation du VG (diamètre télédiastolique en court-axe > 4 cm/m2) (absente si MI aiguë);
- Dilatation de l’OG (diamètre > 5 cm) (absente si MI aiguë);
- Non-coaptation des feuillets ou bascule d’un feuillet en systole;
- Jet de régurgitation traversant toute l’OG (Doppler couleur) (Vidéo);
Vidéo: Insuffisance mitrale centrale sévère; le jet d'IM est large et occupe une grande partie de l'OG et atteint sa paroi postérieure.
- Régurgitation holosystolique (mode TM couleur);
- Diamètre du jet de régurgitation à son origine (vena contracta) ≥ 0.7 cm;
- Large zone de convergence de flux intraventriculaire (PISA) : rayon de 1er aliasing > 1.0 cm (échelle de couleur 40 cm/s) (Vidéo);
Vidéo: insuffisance mitrale excentrique sévère sur prolapsus du feuillet postérieur; le PISA est très développé.
- Orifice de régurgitation > 0.4 cm2;
- Volume régurgité ≥ 60 ml (cette donnée a la meilleure corrélation avec le pronostic clinique);
- Fraction de régurgitation > 50%;
- Reflux systolique dans les veines pulmonaires (inconstant);
- PAPsyst > 60 mmHg à l'effort.
Les critères de sévérité sont plus restrictifs pour l'insuffisance d'origine ischémique, parce que celle-ci traduit une pathologie ventriculaire grave. Une IM secondaire ischlmique ou dilatative est en général considérée comme sévère lorsque les critères suivants sont remplis [16].
- Diamètre de la vena contracta > 0.4 cm;
- Orifice de régusugitation > 0.2 cm2;
- Volume régurgité > 30 mL.
Le diagnostic et la quantification de l'IM se base sur un faisceau de données convergentes et non sur un seul élément qui pourrait être trompeur. Les critères les plus fiables sont ceux qui dépendent le moins des conditions hémodynamiques, tels l'imagerie 2D et 3D, le diamètre de la vena contracta, la taille de la zone d'accélération (PISA) et la surface de l'orifice de régurgitation [15,39]. Dans les insuffisances aiguës, la morphologie de l'OG et du VG n'est pas modifiée; le remodelage est absent, sauf si l'IM aiguë est un accident évolutif dans le cours d'une lésion chronique.
L'ETO pratiqué en salle d'opération est souvent discordant par rapport à l'examen transthoracique effectué auparavant par le cardiologue. En effet, l'anesthésie générale et la ventilation en pression positive modifient considérablement la précharge et la postcharge du VG, au point que l'estimation du degré de sévérité de l'IM diminue de 25-30% sous AG [17]. L'étendue du jet couleur et le diamètre de la vena contracta sont significativement abaissés après l'induction, alors que la SOR et le Vrég sont peu modifiés. Un rétablissement de la postcharge par un vasoconstricteur (phényléphrine) augmente le Vrég sans modifier significativement la SOR [37]. On voit donc que l'AG diminue l'IM et que sa mesure tend à la sousestimer chez 50% des patients, mais que le rétablissement artificiel de l'hémodynamique conduit à une surestimation chez 20% des malades. En chirurgie mitrale, le but de l'ETO peropératoire n'est pas tant de quantifier l'IM, ce qui présente une lourde marge d'erreur, mais de déterminer les bases anatomiques de la maladie, de définir les chances de réussite d'une plastie et de guider l'opérateur dans le choix de la technique.
Fonction du VG
Pour le VG, l'IM est une aubaine! Il dispose d'une précharge suffisante sous pression normale pour se positionner idéalement sur sa courbe de Starling, et sa postcharge est maintenue basse par la soupape de pression que constitue l'IM. La mitrale fuit dès que la pression intraventriculaire dépasse la POG, soit au début de la phase de contraction isovolumétrique. Dans ces conditions, sa fraction d'éjection est excellente, même si une partie du volume systolique est expulsé en arrière. Il faut une atteinte fonctionnelle considérable pour que la FE devienne anormale, ce qui en fait un indice peu sensible de la performance systolique en cas d'IM. Le VG ne commence à souffrir que lorsqu'il se dilate et devient de plus en plus sphérique. Dans ces circonstances, la performance ventriculaire est mieux évaluée par l’épaisseur et la taille du ventricule (diamètre D et surface S en court-axe) en télésystole [3].
- Diamètre (Dts) normal maximal du VG : 4 cm, ou 2.5 cm/ m2;
- Surface (Sts) normale maximale en court-axe (ETO) : 6.5 cm2/m2.
La présence d'une IM permet de mesurer le dP/dt intraventriculaire, puisque la valve fuit dans l'OG dès le début de la contraction. L'accélération du flux de l'IM (pente ascentionnelle du flux spectral) reflète alors le dP/dt du ventricule. On mesure à l'ETO le temps écoulé entre le moment où la vélocité de l'IM est de 1 m/s et celui où elle est de 3 m/s. Ces vélocités correspondant respectivement à 4 et 36 mmHg de gradient de pression entre le VG et l'OG (équation de Bernouilli: ΔP = 4 V2); la valeur normale du dP/dt est de 1’200 à 2’000 mmHg/s (voir Figure 26.19) [43]. De manière simplifiée, la fonction est normale si l'accélération de 1 à 3 m/s dure moins de 27 msec. Tout ralentissment signe une perte de puissance du VG. Cet indice présente l'avantage d'être indépendant de la postcharge, puisque la valve aortique n'est pas encore ouverte pendant la durée de la mesure.
Figure 26.19 : Image spectrale du flux Doppler d’une insuffisance mitrale. La trace dense et compacte traduit une IM sévère. A : fonction normale du VG, Vmax > 5 m/s et pente ascensionnelle très raide. B : fonction du VG diminuée, Vmax plus basse et pente plus faible.
Examen 3D
Le mode tridimensionnel comble substantiellement les lacunes du 2D pour l'examen des structures mitrales et pour les calculs hémodynamiques. Les modes 3D en temps réel sont précieux pour visualiser l'appareil mitral en mouvement, y compris dans l'image "en-face" de la valve où celle-ci est affichée comme vue depuis l'OG (vue chirurgicale); l'image est positionnée de manière à avoir la valve aortique à 10 heures et l'appendice auriculaire gauche à 10 heures [25]. Depuis cette position rétrocardiaque à mi-œsophage, la sonde ETO peut être avancée en position transgastrique et y offrir une excellente image de l'appareil sous-valvulaire. Le 3D en temps réel (X-plane, live-3D et zoom) est particulièrement utile pour diriger les cathéters dans les interventions percutanées [35]. A partir de l'imagerie 3D full-volume, il est possible de procéder à des découpes (cropping) selon n'importe quel plan et de faire ressortir certains éléments (feuillets, anneau) en supprimant les tissus voisins. Grâce à des algorithmes adaptés, on peut ainsi mesurer directement la surface de l'orifice de régurgitation, la surface des feuillets, le volume des prolapsus, le volume de tente, la non-planarité de l'anneau, la localisation des muscles papillaires, la quantification volumétrique du jet d'IM, etc. L'évaluation volumétrique du VG indépendamment de toute approximation géométrique permet un calcul fiable du volume systolique et de la fraction d'éjection, mais dépend de l'acuité de la détection automatique des contours de la cavité ventriculaire [7,19,25].
La superposition du jet couleur sur l'imagerie 3D full-volume définie par une échelle de gris fixe permet une fréquence d'acquisition de 30-40 Hz donnant environ 12 images par systole; en reconstruction off-line, il est possible de faire passer le plan de coupe par la zone la plus étroite de la vena contracta et d'en mesurer la surface, quelle que soit sa forme mais pour autant qu'on soit bien perpendiculaire au flux [6]. Une nouvelle technologie d'optimisation du champ de l'image permet le calcul automatique de la surface du PISA et de la SOR à partir d'un examen 3D avec Doppler couleur en temps réel; la corrélation avec les calculs manuels est excellente et la variabilité est très diminuée, parce que le système ne présuppose pas que le PISA soit hémisphérique mais calcule la surface réelle quelle que soit sa forme [41]. Les programmes semi-automatiques de modelage paramétrique permettent d'extraire des sutructures comme l'anneau et les feuillets mitraux à partir des données de full-volume; on peut ensuite y faire une série de mesures (Figure 11.78) [35,40].
- Diamètre antéro-postérieur de l'anneau: normal < 1.6 cm/m2 (Barlow: > 2.5 cm/m2);
- Surface de l'anneau: normal < 5 cm2/m2 (Barlow: > 7.5 cm2/m2);
- Surface du feuillet antérieur: normal < 2.75 cm2/m2 (Barlow: > 4.75 cm2/m2);
- Diamètre intercommissural: normal < 1.8 cm/m2, sans modification au cours de la systole (Barlow > 1.8 cm/m2, avec élargissement en télésystole);
- Elévation de l'anneau mitral (hauteur de selle): normal 1 cm (Barlow < 0.8 cm);
- Hauteur de ballonnisation: dégénérescence fibro-élastique < 1 cm, Barlow > 1 cm;
- Volume de ballonnisation: dégénérescence fibro-élastique < 1.15 cm3, Barlow > 1.15 cm3;
- Volume de tente (IM secondaire sévère: > 1.5 cm3).
Figure 11.78: Reconstructions 3D de la valve et de l'anneau mitral; images en full-volume en haut et images paramétriques de l'anneau et des feuillets mitraux en-bas. A: prolapsus de P2 (IM type II). B: IM restrictive (type IIIb). L'orifice de régurgitation n'est nullement circulaire comme le présuppose les calculs classiques, mais il a clairement une forme de fente. C: image agrandie d'un prolapsus de P1. Les parties teintées en bleu sont situées en-dessous du plan de l'anneau, celles teintées en rouge sont situées au-dessus du plan de l'anneau [extrait de: Poelaert JI, Bouchez S. Perioperative echocardiographic assessment of mitral valve regurgitation: a comprehensive review. Eur J Cardio-Thor Surg 2016; 50:801-12].
IM primaire vs secondaire
L'importance de l'IM secondaire est beaucoup plus dynamique et fluctuante que celle de l'IM primaire, parce que la première est liée à la fonction ventriculaire alors que la seconde est déterminée par la lésion structurelle des feuillets. La surface de l'orifice de régurgitation de l'IM secondaire augmente significativement au test d'effort, mais diminue considérablement sous anesthésie à cause de la baisse de précharge, de postcharge et de tonus sympathique. Les agents inotropes comme la dobutamine contribuent aussi à sa diminution en réduisant le volume télésystolique du VG, sauf s'ils induisent une ischémie myocardique aiguë [22]. L'absence d'effet de la dobutamine sur l'IM traduit une absence de réserve contractile qui pronostique une dyfonction ventriculaire postopératoire. Une augmentation de précharge (remplissage, Trendelenburg) ou de postcharge (vasopresseur) forcent la dilatation du VG et accroissent la régurgitation secondaire. Au contraire, une IM sur prolapsus ou sur obstruction dynamique de la CCVG diminue dans ces conditions, parce que l'agrandissement du VG exerce une tension sur les cordages qui ramène le prolapsus vers le plan de coaptation dans le premier cas, ou contrecarre l'effet SAM dans le second cas [34].
Le volume régurgité, un élément directement lié au pronostic, dépend de la durée d'ouverture de l'orifice de régurgitation au cours de la systole. Or la surface de cet orifice est une donnée dynamique qui varie au cours de l'éjection. Ainsi la surface de la vena contracta (SVC), qui est calquée sur celle de l'ouverture de régurgitation en systole, présente un pic télésystolique dans les IM primaires (augmentation de 110%). Dans les IM secondaires, la variation de la SVC présente une allure biphasique, avec une augmentation en proto- et en télé-systole (27%), mais une baisse en mésosystole [6]. En appliquant le mode TM sur le flux couleur de l'IM, on observe le même phénomène: dans l'IM primaire, le pic de dimension du PISA survient dans la deuxième moitié de la systole, alors que dans l'IM secondaire, on remarque un pic protosystolique et un deuxième pic télésystolique (Figure 11.79). La raison de cette configuration particulière de l'IM secondaire est le léger rétrécissement de la surface de fuite mitrale lorsque la pression intraventriculaire, qui tend à fermer la mitrale, est à son maximum en méso-systole. Dans l'IM primaire, l'augmentation de pression intraventriculaire en cours de systole tend au contraire à augmenter le prolapsus du feuillet pathologique. Ce phénomène démontre le manque de pertinence des mesures réalisées sur une image immobile (still frame) sélectionnée à un instant aléatoire de la systole et la difficulté à comparer les IM primaires et les IM secondaires avec les mêmes critères.
Figure 11.79: Evolution de l'IM au cours de la systole décrite par celle de la surface de la vena contracta. En rouge: IM fonctionnelle; répartition temporelle biphasique avec une diminution méso-systolique. En bleu: IM structurelle (maladie de Barlow); la surface de la vena contracta s'accroît progressivement pour culminer en télésystole [6].
IM secondaire
La prévalence d'IM secondaire est de 28% chez les patients souffrant d'ischémie myocardique et de 50% chez ceux qui sont en insuffisance ventriculaire gauche [42,44]. La découverte d'une IM significative à l'examen ETO pré-CEC est donc fréquente pour l'anesthésiste échocardiographeur. Cette insuffisance est de type IIIb, symétrique en cas de dilatation du VG et asymétrique en cas d'ischémie focalisée. La caractéristique échocardiographique de l'IM secondaire est le maintien d'un ou des deux feuillets mitraux en-dessous du plan de l'anneau mitral en systole à cause de la traction excessive exercée par les cordages ancrés sur une paroi ventriculaire localement ou globalement dilatée. Le point de coaptation est situé à une certaine distance intraventriculaire du plan de l'anneau. Le triangle formé en systole par le plan de l'anneau et les deux feuillets ressemble à une tente (à l'envers en ETO mais à l'endroit en ETT); il détermine quelques paramètres permettant de quantifier la sévérité du degré de déformation mitrale liée à la pathologie ventriculaire (Figure 11.80) (voir IM secondaire ischémique) [33,38].
- Diamètre de l'anneau (> 3.4 cm);
- Distance entre le point de coaptation et le plan de l'anneau: distance de tente (tenting distance) ≥ 1.1 cm;
- Surface entre le plan de l'anneau et les feuillets mitraux: surface de tente (tenting surface) ≥ 2.5 cm2;
- Volume entre le plan de l'anneau et les feuillets mitraux (3D): volume de tente (tenting volume) ≥ 3.0 cm3;
- Angle du feuillet antérieur avec le plan de l'anneau (> 20°);
- Angle du feuillet postérieur avec le plan de l'anneau (> 30°);
- Déformation en "aile de mouette" (seagull sign) du feuillet antérieur par traction des cordages secondaires implantés sur le corps du feuillet; ceci survient lors de déplacement vers l'extérieur d'un muscle papillaire à cause d'une ischémie de la paroi sous-jacente (postérieure ou antéro-latérale) (Figure 11.65B).
- Pseudo-prolapsus: la traction excessive sur un feuillet alors que l'autre reste en place engendre un jet d'IM excentrique qui peut être confondu avec celui d'un prolapsus du feuillet opposé (Figure 11.81).
Figure 11.80 : IM restrictive (Type IIIb) sur dilatation du VG. Le degré de restriction est défini par la distance du point de coaptation au plan de l’anneau mitral (distance de tente), la surface triangulaire comprise entre les feuillets et le plan de l’anneau (surface de tente), et l’angle de fermeture du feuillet antérieur mesuré entre le plan de l’anneau et l’extrémité du feuillet [36]. Le rapport des diamètres du VG en long axe et en court axe définit le degré de sphéricisation de celui-ci (rapport normal long-axe / court-axe : > 1.5).
Figure 11.65B : Akinésie ou dyskinésie segmentaire entraînant le muscle papillaire vers l’extérieur avec une traction excessive sur les codages de 2ème ordre du feuillet antérieur dans une insuffisance mitrale ischémique; ceci se traduit par une image en aile de mouette du feuillet antérieur. < FA : angle du feuillet antérieur à son extrémité avec le plan de l’anneau en systole. La section chirurgicale des cordages de 2ème ordre peut être curative dans ce cas de figure.
Figure 11.81 : Insuffisance mitrale excentrique dirigée vers la paroi latéro-postérieure de l’OG ; elle peut être due à un prolapsus du feuillet antérieur (FA) ou à une restriction du feuillet postérieur (FP). Dans le premier cas, le feuillet antérieur est basculé en arrière du plan de l’anneau mitral (prolapsus vrai), alors que dans le second le feuillet postérieur est maintenu en dessous du plan de l’anneau (faux prolapsus). Dans les deux cas, le jet a la même direction.
Ces mesures sont réalisées en vue mi-œsophage 4-cavités 0° et long-axe 120° en télésystole. L'IM secondaire est considérée comme sévère lorsque la surface de l'orifice de régugitation (calculée par le PISA ou la vena contracta) est > 0.2 cm2 et le volume de régugitation > 30 mL. Au problème de la forme en croissant et non-circulaire de l'orifice de régurgitation s'ajoute l'atteinte ischémique ou fonctionnelle du VG que peut décompenser une IM même modérée. Un diamètre de vena contracta ≥ 0.4 cm et une surface de régurgitation de ≥ 0.2 cm2 sont associés à une élévation de la mortalité [16]. Ces remarques justifient les seuils plus bas pour la définition de l'IM sévère lorsqu'elle est secondaire.
D'autres éléments non-valvulaires importants font partie de l'évaluation quantitative d'une IM secondaire [38].
- Taille de d'OG; une dilatation massive de l'OG entraine une dilatation de l'anneau mitral; elle est un facteur de mauvais pronostic.
- Taille et fonction du VG; avec la dilatation, le VG devient plus sphérique. Cette sphéricisation est un phénomène majeur dans la distortion de l'appareil sous-valvulaire. Il existe deux manières différentes de calculer l'indice de sphéricité du VG.
- Rapport entre le diamètre du court-axe (vue transgastrique) et la longueur du long-axe (vue 2-cavités 90° ou long-axe 120°); valeur normale: < 0.7;
- Rapport entre le volume télédiastolique (méthode de Simpson) et le volume d'une sphère fictive dont le diamètre est la distance entre le plan de l'anneau mitral et l'apex du VG; valeur normale: < 0.25.
- Anomalie de la cinétique segmentaire; l'étendue de la lésion ischémique est moins importante que sa localisation dans le voisinage d'un muscle papillaire.
Les IM secondaires sont particulièrement sensibles aux conditions hémodynamiques du patient; elles fluctuent avec la précharge, la postcharge et la fonction ventriculaire dans une bien plus grande mesure que les IM structurelles. Sous anesthésie, il est donc capital de les évaluer lorsque le malade est équilibré.
Examen ETO avant plastie mitrale
L'anesthésiste-échocardiographeur doit fournir au chirurgien des données suffisantes pour évaluer les chances de réussite d'une plastie. L’examen ETO pratiqué avant la CEC offre une vision dynamique de la valve et permet de juger si une plastie est faisable dans des conditions satisfaisantes. On recherche en particulier quelques données-clefs pour l'opérateur [27,28].
- Quantification de l'IM (tendance à la sous-estimation en AG): PISA, vena contracta;
- Mécanisme de l’IM : restriction, prolapsus, rupture de cordage, dilatation;
- Localisation exacte de l’origine du/des jet(s) d’IM;
- Etat des 2 commissures;
- Etat de l’anneau (calcifications) et de l’appareil sous-valvulaire, dimensions de l'anneau;
- Flux mitral et veineux pulmonaire;
- Fonction et taille du VG, remodelage ventriculaire, taille de l’OG;
- Mesures spécifiques (voir ci-dessous): diamètres de l’anneau, distance intercommissurale, longueur du feuillet antérieur;
- Dans les IM secondaires restrictives; distance de tente, angle des feuillets en systole;
- Risques d'obstruction dynamique de la CCVG après plastie (voir Figure 11.49).
- Distance entre le point de coaptation et le septum (C-sept) < 2.6 cm;
- Distance entre le point de coaptation et le plan de l'anneau > 0.6 cm;
- Longueur du feuillet postérieur > 1.5 cm;
- Rapport longeur feuillet antérieur/feuillet postérieur < 1.3;
- Angle mitro-aortique < 140°.
Figure 11.49 : Eléments prédicteurs de bascule du feuillet antérieur dans la chambre de chasse en postopératoire (SAM systolic anterior motion). a : rapport hauteur du feuillet antérieur / hauteur du feuillet postérieur < 1.3. b : distance entre le point de coaptation et le septum < 2.6 cm. c : hauteur du feuillet postérieur déployé en diastole > 1.5 cm. d : angle mitro-aortique refermé (< 140°)
La taille de l'anneau prothétique est choisie en fonction de la distance intertrigonale, qui n'est pas modifiée par la dilatation de l'anneau mitral; à l'ETO 2D, elle se calcule en multipliant par 0.8 la longueur de la base du feuillet antérieur en vue bicommissurale 60° avec rotation horaire de la sonde; en 3D (vue "en-face"), elle se calcule de la même manière à partir de la distance intercommissurale (voir Figure 11.52A).
Figure 11.52A : Mesure de la distance intercommissurale par reconstruction ETO 3D de la valve mitrale "en face" comme vue depuis l'OG. FA: feuillet antérieur. FP: feuillet postérieur.
Certains critères échocardiographiques permettent de prédire une bonne faisabilité et un bon résultat de la plastie [26,28,45].
- Diamètre de l’anneau < 5.0 cm (mesures en vues mi-oesophagiennes bicommissurale 40-60° et long axe 120-140°);
- Longueur du feuillet antérieur > 3.0 cm, rapport longueur feuillet antérieur / diamètre de l’anneau > 0.65 (mesures en diastole et en vue long axe 120-140°);
- Lésion de < 3 festons, commissures stables;
- Degré d’IM modérée-à-sévère mais < massive;
- Jet unique;
- Appareil sous-valvulaire satisfaisant;
- Absence de calcification de l’anneau.
Pour les IM secondaires de type restrictif (IIIb), les critères sont un peu différents (voir Figure 11.80):
- Distance plan de l’anneau – point de coaptation (tenting height) < 1.0 cm;
- Surface entre le plan de l’anneau et les feuillets (tenting area) < 1.6 cm2;
- Angle de fermeture du feuillet antérieur ≤ 20°;
- Angle de fermeture du feuillet postérieur ≤ 35°;
- Index de sphéricité du VG ≥ 1.5 (pas de dilatation majeure).
L’imagerie tridimensionnelle permet de se rendre compte avec une plus grande précision de l’anatomie et des mouvements de la valve mitrale. Elle permet notamment de déterminer la taille de l’anneau mitral à implanter d’après les mesures de la distance intercommissurale, de la hauteur du feuillet antérieur et des diamètres de l’anneau (voir Figures 11.74 et 11.78) (Vidéos) [10,18,25,39].
Vidéo: Vue tridimensionnelle depuis l'OG d'un prolapsus du feston antérieur du feuillet postérieur (P1) avec rupture de cordage (à l'écran, partie inférieure gauche de la valve).
Vidéo: Vue tridimensionnelle depuis l'OG d'un prolapsus du feston antérieur du feuillet postérieur (P2) avec rupture de cordage (à l'écran, partie inférieure médiane de la valve).
Vidéo: Vue tridimensionnelle depuis l'OG d'un prolapsus du feston antérieur du feuillet postérieur (P1) avec rupture de cordage (à l'écran, partie inférieure gauche de la valve).
Vidéo: Vue tridimensionnelle depuis l'OG d'un prolapsus du feston antérieur du feuillet postérieur (P2) avec rupture de cordage (à l'écran, partie inférieure médiane de la valve).
Certaines données rendent le succès peu probable et la récidive fréquente (> 50% des cas) [9,21,24,27,28].
- Implication de ≥ 3 festons;
- Implication des 2 feuillets;
- Feuillets raccornis et peu développés, fusion commissurale (RAA, endocardite);
- Longueur du feuillet antérieur < 2.8 cm et du feuillet postérieur < 1.7 cm;
- Orifice de régurgitation très large (> 0.4 cm2);
- Dilatation annulaire massive (diamètre > 5.0 cm pour les IM structurelles et > 4.0 cm pour les IM fonctionnelles) ou anneau très restrictif (diamètre < 3.5 cm);
- Calcifications étendues.
Dans les IM ischémiques secondaires, un diamètre annulaire > 37 mm, une hauteur de tente > 11 mm, une surface de tente > 1.6 cm2, un angle du feuillet antérieur > 25°, un angle du feuillet postérieur > 45° et une IM sévère au jet couleur sont des indicateurs d'un risque de récidive de 50% [21]. Une forte dilatation du VG (diamètre télédiastolique > 6.0 cm, écartement des muscles papillaires en télésystole > 2.5 cm) est aussi un handicap [28,33].
Examen ETO après plastie mitrale
L'image ETO de la valve après plastie peut paraître bizarre parce que la restauration d'une fonction normale n'est pas synonyme d'une anatomie normale. En général, le feuillet postérieur sert de butée au feuillet antérieur qui assure à lui seul l'ouverture et la fermeture (valve unicuspide). Après la CEC, les critères échocardiographiques de réussite d’une plastie mitrale (Figure 11.55) sont définis pour une postcharge (pression artérielle), une précharge (volémie) et une fonction ventriculaire normales. L’examen doit être accompagné d’un test de postcharge (PAM > 80 mmHg, PAsyst > 120 mmHg) et d’une stimulation de la contractilité, pour être certain que les résultats obtenus correspondent aux situations de la vie réelle. La plastie est considérée comme réussie lorsque les conditions suivantes sont réunies [13,29].
Figure 11.55 : Images ETO après plastie mitrale. A : après résection large de P2 et plastie du feuillet postérieur, toute l’occlusion est assurée par le feuillet antérieur ; sa longueur doit dépasser le diamètre de l’anneau (flèches) et permettre un affrontement sous le feuillet postérieur pour que la valve soit occlusive. B : occlusion satisfaisante du feuillet antérieur en butée sous le feuillet postérieur et l’anneau en systole. C : la coaptation des feuillets doit se faire sur une hauteur d’au moins 4 mm (flèche jaune) pour assurer l’étanchéité, ce qui est le cas ici après une plastie et résection du feuillet antérieur. D : fuite résiduelle après plastie mitrale ; si elle est pansystolique, cette fuite est excessive car le jet présente une largeur significative au passage de la valve.
- IM résiduelle de degré ≤ mineur ; IM résiduelle protosystolique et brêve; absence d'IM résiduelle (Vidéo).
Vidéo: Vue de la valve mitrale après plastie-résection du feuillet postérieur; le feuillet antérieur est seul à assurer la fermeture, il vient en butée sous la partie postérieure de l'anneau prothétique; il n'y a pas d'IM résiduelle.
- Si résection du feuillet postérieur : abutement du feuillet antérieur sous le feuillet postérieur et la partie postérieure de l’anneau (Vidéo).
Vidéo: Vue de la valve mitrale après plastie du feuillet postérieur; le feuillet antérieur est seul à assurer la fermeture, il vient en butée sous le feuillet postérieur et l'anneau prothétique.
- Si affrontement des 2 feuillets : auteur de coaptation > 5-8 mm; cette hauteur se calcule en soustrayant la distance entre l'anneau mitral et le point de coaptation en systole de la longueur totale du feuillet antérieur mesurée en diastole (vue long-axe 120°) (voir Figure 11.22).
- Rapport hauteur de coaptation / longueur feuillet antérieur > 0.2.
- Rapport longueur feuillet postérieur / feuillet antérieur < 0.4.
- Gradient antérograde : ΔPmax ≤ 4 mmHg, ΔPmoy ≤ 2 mmHg ; le temps de demi-pression (pressure half-time) n'est pas adapté au calcul de la surface d'ouverture qui n'est pas circulaire.
- Vmax ≤ 1.5 m/s dans la CCVG, pas de SAM (voir Plastie mitrale "Effet CMO" après PVM).
Les indications échocardiographiques à retourner en pompe (environ 10% des cas) pour compléter la plastie ou, à défaut, remplacer la valve sont les suivantes [12,29].
- Défaut structurel qui ne peut pas s’améliorer : perforation, déhiscence, bascule de feuillet, fuite para-annulaire ≥ mineure (Vidéo);
Vidéo: Fuite para-annulaire après plastie mitrale; la fuite est située à la jonction mitro-aortique.
- IM de degré ≥ mineure-à-modérée:
- Non-coaptation des feuillets en image 2D ou 3D;
- Jet d’IM important et pansystolique (Vidéo);
Vidéo: Insuffisance mitrale excessive après plastie mitrale; l'IM excentrique majeure est due à un basculement du feuillet antérieur dans l'OG en systole; cette plastie est un échec.
- Présence d'un PISA côté ventriculaire;
- Vena contracta > 0.3 cm;
- Orifice de régurgitation > 0.25 cm2;
- Volume de régurgitation > 25 mL;
- Sténose restrictive : S < 2.0 cm2, ΔPmax ≥ 10 mmHg, ΔPmoy ≥ 5 mmHg;
- SAM réfractaire au traitement médical (voir Plastie mitrale "Effet CMO" après PVM);
- La décision est prise en fonction du contexte clinique et non de la seule image ETO.
La mesure du gradient, de la surface utile en diastole et de la surface de l'orifice de régurgitation en systole est complexe, car la surface d'ouverture n'est pas circulaire et l'axe du flux oblique par rapport au faisceau Doppler. Le calcul par le temps de demi-pression (pressure half-time), réservé aux valves dont la surface est < 1.5 cm2, est inadapté à la géométrie irrégulière de l'orifice et à l'écart entre l'axe du flux diastolique et l'axe du Doppler. Dans ces conditions, la planimétrie après découpe (cropping) soigneuse de la reconstruction 3D est plus précise. Un gradient excessif peut apparaître en cas de surcharge liquidienne (transfert trop rapide du volume de la CEC) ou de haut débit cardiaque (excès de catécholamines). Ces facteurs doivent être contrôlés avant de décider d'un retour en pompe. A l'inverse, un bas débit cardiaque, une dysfonction diastolique sévère ou une insuffisance aortique associée peuvent masquer la réalité en diminuant artificiellement le gradient diastolique [12].
Il est essentiel de diagnostiquer le mécanisme de l'insuffisance résiduelle pour que le chirurgien puisse réaliser une correction adéquate [13].
- IM de type I (jet central dans l'OG): anneau trop grand, perforation iatrogène, fente résiduelle (cleft);
- IM de type II (jet excentrique dirigé à l'opposé du feuillet prolabant): prolapsus résiduel, dont la localisation est à définir précisément;
- IM de type III (jet excentrique dans la direction du feuillet restrictif): résection excessive, malposition de l'anneau, raccourcissement trop important de cordages, dilatation ventriculaire;
- IM due au SAM: jet méso-télé-systolique, feuillet postérieur trop long, excès de tissu valvulaire, anneau trop petit.
Lors de pose d’un anneau de valvuloplastie, il est important de contrôler trois éléments après la mise en charge.
- Contractilité de la paroi latérale ; l’artère circonflexe (CX) peut être lésée par les points de fixation latéraux.
- Etanchéité de la valve aortique ; les points au niveau de la base du feuillet antérieur peuvent exercer une traction sur la cuspide gauche ou la cuspide non coronaire de la valve aortique et provoquer une IA. Ils peuvent également perforer un feuillet aortique.
- Intégrité de la paroi-basale du VG ; la décalcification de l’anneau peut entraîner des lésions au niveau du sillon auriculo-ventriculaire ; la présence continue d’air dans le VG et l’akinésie basale sont des signes avant-coureurs de la rupture ventriculaire.
| Insuffisance mitrale à l'ETO |
|
Définition de l’IM sévère (chronique) (IM structurelle primaire):
- Signe d’appel : large jet couleur de régurgitation, traversant toute l’OG
- Dilatation du VG (Dts > 4 cm/m2) et de l’OG (> 5 cm)
- Non-coaptation des feuillets ou bascule d’un feuillet dans l’OG
- Diamètre du jet de régurgitation à son origine > 0.7 cm
- Orifice de régurgitation ≥ 0.4 cm2
- Volume régurgité ≥ 60 mL
- PAPsyst à l’effort > 60 mmHg
En cas d’IM aiguë, les cavités gauches ne sont pas dilatées.
Les critères de sévérité sont plus restrictifs pour l’IM secondaire sévère:
- Diamètre de la vena contracta > 0.4 cm
- Orifice de régusugitation > 0.2 cm2
- Volume régurgité > 30 mL
- Diamètre de l'anneau > 3.5 cm
- Distance de tente (tenting distance) > 1.1 cm
- Surface de tente (tenting surface) > 2.5 cm2
Facteurs prédictifs d'une bonne faisabilité de plastie mitrale:
- Diamètre de l’anneau < 5.0 cm
- Rapport longueur feuillet antérieur / diamètre de l’anneau > 0.65
- Lésion de < 3 festons, commissures stables
- IM modérée-à-sévère, jet unique
- Appareil sous-valvulaire satisfaisant
- Absence de calcification de l’anneau
Critères défavorables pour une plastie:
- Implication de ≥ 3 festons
- Implication des 2 feuillets
- Longueur du feuillet antérieur < 2.8 cm et du feuillet postérieur < 1.7 cm
- Orifice de régurgitation > 0.4 cm2
- Dilatation annulaire massive ou anneau très restrictif
- Calcifications étendues
- Pour l'IM secondaire (ischémie, dilatation VG): hauteur de tente > 1.1 cm, surface de tente > 2.5 cm2, diamètre annulaire > 3.7 cm
Critères de réussite d'une plastie:
- IM résiduelle de degré ≤ mineur
- Abutement du feuillet antérieur sous le feuillet postérieur
- Auteur de coaptation > 5-8 mm
- Rapport hauteur de coaptation / longueur feuillet antérieur > 0.2
- Rapport longueur feuillet postérieur / feuillet antérieur < 0.4
- Gradient antérograde : ΔPmax ≤ 4 mmHg, ΔPmoy ≤ 2 mmHg
- Vmax ≤ 1.5 m/s dans la CCVG, pas de SAM
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Novembre 2019
Références
- ASHIKHMINA E, SHOOK D, COBEY F, et al. Three-dimensional versus two-dimensional echocardiographic assessment of functional mitral regurgitation proximal isovelocity area. Anesth Analg 2015; 120:534-42
- BAUMGARTNER H, FALK V, BAX JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38:2739-86
- BORROW K, GREEN LH, MANN T, et al. End-systolic volume as a predictor of postoperative left ventricular performance in volume overload from valvular regurgitation. Am J Med 1980; 68:655-60
- CARPENTIER A, CHAUVAUD S, FABIANI JN, et al. Reconstructive surgery of mitral valve incompetence. J Thorac Cardiovasc Surg 1980; 79:338-48
- CHERRY SV, JAIN P, RODRIGUEZ-BLANCO YF, FABBRO M. Noninvasive evaluation of native valvular regurgitation: a review of the 2017 American Society of Echocardiography Guidelines for the perioperative echocardiographer. J Cardiothorac Vasc Anesth 2018; 32:811-22
- COBEY FC, ASHIHKMINA E, EDRICH T, et al. The mechanism of mitral regurgitation influences the temporal dynamics of the vena contracta area as measured with color flow Doppler. Anesth Analg 2016; 122:321-9
- COBEY FC, FERREIRA R, URSPRUNG WW, et al. A novel approach to assess the three.dimensional anatomy of a mitral valve regurgitant orifice. J Cardiothorac Vasc Anesth 2017; 31:169-73
- COBEY FC, PATEL V, GOSLING A, URSPRUNG E. The emperor has no clothes: recognizing the limits of current echocardiographic technology in perioperative quantification of mitral regurgitation. J Cardiothorac Vasc Anesth 2017; 31:1692-4
- DE BONIS M, AL-ATTAR N, ANTUNES M, et al. Surgical and interventional management of mitral valve regurgitation: a position statement from the European Society of Cardiology working groups on Cardiovascular Surgery and Valvular Heart Disease. Eur Heart J 2016; 37:133-9
- ENDER J, EIBEL S, MUKHERJEE C, et al. Prediction of the annuloplasty ring size in patients undergoing mitral valve repair using real-time three-dimensional transoesophageal echocardiography. Eur J Echocardiogr 2011; 12:445-53
- ENRIQUEZ-SARANO M, MILLER FA, HAYES SN, et al. Effective mitral regurgitant orifice area: clinical use and pitfalls of the proximal isovelocity surface area method. J Am Coll Cardiol 1995; 25:703-9
- ESSANDOH M. Intraoperative echocardiographic assessment of mitral valve area after degenerative mitral valve repair: a call for guidelines or recommendations. J Cardiothorac Vasc Anesth 2016; 30:1364-8
- FISCHER GW, ANYANWU AC, ADAMS DH. Intraoperative classification of mitral valve dysfunction: The role of the anesthesiologist in mitral valve reconstruction. J Cardiothorac Vasc Anesth 2009; 23:531-43
- FOSTER E. Mitral regurugitation due to degenerative mitral-valve disease. N Engl J Med 2010; 363:156-65
- GISBERT A, SOULIERE V, DENAULT AY, et al. Dynamic quantitative echocardiographic evaluation of mitral regurgitation in the operating department. J Am Soc Echocardiogr 2006; 19:140-6
- GRAYBURN PA, CARABELLO B, HUNG J, et al. Defining "severe" secondary mitral regurgitation. Emphasizing an integrated approach. J Am Coll Cardiol 2014; 64:2792-801
- GREWAL KS, MALKOWSKI MJ, PIRACHA AR, et al. Effect of general anesthesia on the severity of mitral regurgitation by transesoophageal echocardiography. Am J Cardiol 2000; 85:199-203
- GREWAL J, MANKAD S, FREEMAN WK. Real-time three-dimensional transesophageal echocardiography in the intraoperative assessment of mitral valve disease. J Am Soc Echocardiogr 2009; 22:34-41
- HIEN MD, RAUCH H, LICHTENBERG A, et al. Real-time three-dimensional transesophageal echocardiography: improvements in intraoperative mitral valve imaging. Anesth Analg 2013; 116:287-95
- IZUMO M, SHIOTA M, KAR S, et al. Comparison of real-time three.dimensional transoesophageal echocardiography to two-dimensional transoesophageal echocardiographyfor quantification of mitral valve prolapse in patients with severe mitral regurgitation. Am J Cardiol 2013; 111:588-94
- KONGSAEREPONG V, SHIOTA M; GILLINOV AM, et al. Echocardiographic predictors of successful versus unsuccessful mitral valve repair in ischemic mitral regurgitation. Am J Cardiol 2006; 98:504-8
- LANCELLOTTI P, FATTOUCH K, LA CANNA G. Therapeutic decision-making for patients with fluctuating mitral regurgitation. Nat Rev Cardiol 2015; 12:212-9
- LANCELLOTTI P, MOURA L, AGRICOLA E, et al. European Association of Echocardiography recommendations for the assessment of valvular regurgitation. Part 2: mitral and tricuspid regurgitation (native valve disease). Eur J Echocardiogr 2010; 11:307-32
- LANCELLOTTI P, TRIBOUILLOY C, HAGENDORFF A, et al. Recommendations for the echocardiographic assessment of native valvular regurugitation: an executive summary from the EACI. Eur Heart J Cardiovasc Imaging 2013; 14:611-44
- LANG RM, BADANO LP, TSANG W, et al. EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiography. Eur Heart J Cardiovasc Imaging 2012; 13:1-46
- LEE APW, ACKER M, KUBO SH, et al. Mechanisms of recurrent functional mitral regurgitation after mitral valve repair in nonischemic dilated cardiomyopathy. Circulation 2009; 119:2606-14
- MAHMOOD F, MATYAL R. A quantitative approach to the intraoperative echocardiographic assessment of the mitral valve for repair. Anesth Analg 2015; 121:34-58
- MASLOW A. Mitral valve repair: an echocardiographic review: Part I. J Cardiothorac Vasc Anesth 2015; 29:156-77
- MASLOW A. Mitral valve repair: an echocardiographic review: Part II. J Cardiothorac Vasc Anesth 2015; 29:439-71
- MATSUMARA Y, FUKUDA S, TRAN H. Geometry of the proximal isovelocity surface area in mitral regurgitation by 3-dimensional color Doppler echocardiography: difference between functional mitral regurgitation and prolapse regurgitation. Am Heart J 2008; 155:231-8
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. J Am Coll Cardiol 2017; 70:252-89
- NISHINO S, WATANABE N, KIMURA T, et al. Acute versus chronic ischemic mitral regurgitation. An echocardiographic study of anatomy and physiology. Circ Cardiovasc Imaging 2018; 11:e007028
- O'GARA PT, GRAYBURN PA, BADHWAR V, et al. 2017 ACC Expert consensus décision pathway on the management of mitral regurgitation. J Am Coll Cardiol 2017; 70:2421-49
- POELART JI, BOUCEZ S. Perioperative echocardiographic assessment of mitral valve regurgitation: a comprehensive review. Eur J Cardio-Thor Surg 2016; 50:801-12
- RYAN L, JACKSON B, PARISH L, et al. Quantification and localization of mitral valve tenting in ischemic mitral regurgitation using real-time three-dimensional echocardiography. Eur J Cardiothorac Surg 2007; 31:839-4
- SANFILIPPO F, JOHNSON C, BELLAVIA D, et sl. Mitral regurgitation grading in the operating room: a systematic review and meta-analysisi comparing preoperative and intraoperative assessments during cardiac surgery. J Cardiothorac Vasc Anesth 2017; 31:1681-91
- SHAKIL O, JAINANDUNSING JS, ILIC R, et al. Ischemic mitral regurgitation: an intraoperative echocardiographic perspective. J Cardiothorac Vasc Anesth 2013; 27:573-85
- SUGENG L, CHANDRA S, LANG RM. Three-dimensional echocardiography for assessment of mitral valve regurgitation. Curr Opin Cardiol 2009; 24:420-5
- SUGIMOTO T, DULGHERU R, MARCHETTA S, et al. What does 3D echocardiography ass to 2D echocardiography in the assessment of mitral regurgitation ? Curr Cardiol Rep 2017; 19:90
- TAN TC, ZENG X, JIAO Y, et al. Three-dimensional field optimization method: clinical validation of a novel color Doppler method for quantifying mitral regurgitation. J Am Soc Echocardiogr 2016; 29:926-34
- TRICHON BH, FELKER GM, SHAW LK, et al. Relation of frequency and severity of mitral regurgitation to survival among patients with left ventricular systolic dysfunction and heart failure. Am J Cardiol 2003; 91:538-43
- VUILLE C, WEYMAN AE. Left ventricle I: general considerations, assessment of chamber size and function. In: WEYMAN AE (ed). Principles and practice of echocardiography. Philadelphia: Lea & Febiger, 1994, 575-624
- WIERUP P, NIELSEN SL, EGELBLAD H, et al. The prevalence of moderate mitral regurgitation in patients undergoing CABG. Scand Cardiovasc J 2009; 43:46-9
- YAMAUCHI T, TANIGUCHI K, KUKI S, et al. Evaluation of the mitral valve leaflet morphology after mitral valve reconstruction with a concept of “coaptation length index”. J Card Surg 2005; 20:432-5
- ZOGHBI WA, ADAMS D, BONOW RO, et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the ASE developped in collaboration with the SCMR. J Am Soc Echocardiogr 2017; 30:303-71
11. Anesthésie et valvulopathies
- 11.1 Introduction : prévalence et risques des valvulopathies
- 11.2 Rappel physiopathologique général
- 11.3 Imagerie valvulaire
- 11.4 Situations particulières
- 11.5 Chirurgie valvulaire
- 11.6 Insuffisance mitrale
- 11.6.1 Etiologie de l'insuffisance mitrale
- 11.6.2 Physiopathologie
- 11.6.3 Manifestations cliniques
- 11.6.4 Echocardiographie de l'insuffisance mitrale
- 11.6.5 Indications et résultats opératoires
- 11.6.6 Principes pour l'anesthésie
- 11.6.7 CEC et post CEC
- 11.6.8 IM primaire sur maladie de Barlow
- 11.6.9 IM secondaire sur ischémie myocardique
- 11.6.10 IM secondaire sur défaillance du VG
- 11.7 Sténose mitrale
- 11.8 Sténose aortique
- 11.8.1 Nosologie
- 11.8.2 Physiopathologie
- 11.8.3 Manifestations cliniques
- 11.8.4 Echocardiographie de la sténose aortique
- 11.8.5 Indications et résultats opératoires
- 11.8.6 Principes pour l'anesthésie en chirurgie cardiaque
- 11.8.7 CEC et post-CEC
- 11.8.8 Sténose sous-aortique dynamique
- 11.8.9 Anesthésie pour la chirurgie non-cardiaque
- 11.9 Insuffisance aortique
- 11.10 Maladie aortique
- 11.11 Pathologie tricuspidienne
- 11.12 Pathologie de la valve pulmonaire
- 11.13 Polyvalvulopathies
- 11.14 Conclusions





























